
科目: 来源:2013届福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
下列数据是对应物质的熔点(单位:℃)
|
Na2O |
NaCl |
AlF3 |
AlCl3 |
BCl3 |
Al2O3 |
CO2 |
SiO2 |
|
920 |
801 |
1291 |
190 |
-107 |
2073 |
-57 |
1723 |
据此做出的下列判断中,正确的是 ( )
A、铝的化合物晶体类型完全相同
B、原子晶体的熔点一定比离子晶体高
C、同族元素的氧化物一定形成相同类型的晶体
D、不同族元素的氧化物可形成相同类型的晶体
查看答案和解析>>
科目: 来源:2013届福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
下列变化或数据与氢键无关的是
A、HCl、HBr、HI的沸点逐渐升高
B、常温常压下,氨气在水中的溶解度是1:700
C、对羟基苯甲醛的沸点比邻羟基苯甲醛的高
D、甲酸蒸气的密度在373K,101kPa时为1.335g·L-1,在293K,101kPa时为2.5g·L-1
查看答案和解析>>
科目: 来源:2013届福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
阿伏加德罗常数约为6.02×1023mol-1,表示为NA,下列叙述中正确的是
A、31g 白磷分子(P4)中含有P—P键个数为1.5NA
B、常温常压下,22.4L O2和O3的混合气体所含分子数为NA
C、1L 1.0 mol/L氨水中,NH3·H2O的分子数为NA
D、20g 重水(D2O)中含有的中子数为8 NA
查看答案和解析>>
科目: 来源:2013届福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
列各组微粒,不能互称为等电子体的是
A、NO2、NO2+、NO2- B、CO2、N2O、N3-
C、CO32-、NO3-、SO3 D、N2、CO、CN-
查看答案和解析>>
科目: 来源:2013届福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
对于SO2和CO2的说法中正确的是 ( )
A、都是直线形结构 B、中心原子都采用sp杂化类型
C、SO2为V形结构,CO2为直线形结构 D、S原子和C原子上都没有孤对电子
查看答案和解析>>
科目: 来源:2013届福建省高二下学期期末考试化学试卷(解析版) 题型:填空题
(10分)下列分子结构图中的 表示氢原子,
表示氢原子, 表示短周期的相邻的三种元素原子。小黑点表示没有形成共价键的最外层电子,短线表示共价键。
表示短周期的相邻的三种元素原子。小黑点表示没有形成共价键的最外层电子,短线表示共价键。
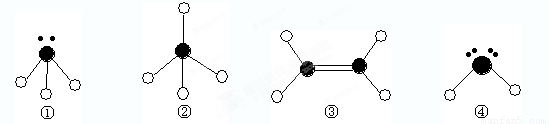
(1)以上分子中,中心原子采用sp2杂化的是 (填化学式);
(2)在③的分子中有 个σ键。在③与溴的四氯化碳溶液反应中,断裂的是③分子中的 键(填“σ”或“π”),形成的是 键(填“σ”或“π”)。
(3)4种分子中,属于极性分子的是 (填序号,下同)。键角由大到小的顺序是 ,能结合质子(即H+)形成稳定离子的是 ,形成 键(按电子对提供方式分类)。
(4)已知液态①和④相似,也可发生微弱的电离,电离出含有相同电子数的微粒,则①的电离方程式为: ;
查看答案和解析>>
科目: 来源:2013届福建省高二下学期期末考试化学试卷(解析版) 题型:填空题
(9分)长期以来一直认为氟的含氧酸不存在。但是至1971年斯图杰尔和阿佩里曼(美)成功地合成了次氟酸后,这种论点被剧烈地动摇了。他们是在0℃以下将氟化物从细冰末的上面通过,得到毫克量的次氟酸。
⑴以下两种结构式,能正确表示次氟酸结构的是 。A、H—O—F B、H—F—O
⑵次氟酸中氧元素的化合价为 ,次氟酸的电子式为 ,次氟酸分子中共价键的键角 180°(填“<”或“=”)。
⑶下面给出了几个分子和基团化学键的键能:
|
|
H2 |
O2 |
F2 |
OH |
OF |
HF |
|
E/(kJ/mol) |
432 |
494 |
155 |
424 |
220 |
566 |
请计算反应 2HOF(g) = 2HF(g) + O2(g)的反应热(△H),近似为 kJ/mol。从计算结果预测次氟酸的一条化学性质: 。
⑷次氟酸能被热水瞬间分解,生成一种常见的物质M,M是18e-,且被称为“绿色氧化剂”。写出次氟酸与热水反应的化学方程式: 。
查看答案和解析>>
科目: 来源:2013届福建省高二下学期期末考试化学试卷(解析版) 题型:推断题
(11分)A、B、C、D、E、F六种短周期元素的原子序数依次增大。A是宇宙中含量最丰元素,B元素的原子价电子排布为nsnnpn,D元素的最外层电子数是其电子层数的3倍,F的最高价氧化物对应水化物有两性,能溶于C、E的最高价氧化物对应水化物中。试回答
(1)写出C原子的价层电子轨道表示式: ;D原子的价层电子排布式:___________,E的原子结构示意图:___________;
(2)B位于元素周期表的第 族,A、B形成原子个数比1:1且直线形分子的结构式: ;
(3)C的基态原子核外有 种不同运动状态的电子;
(4)E单质在空气中燃烧生成物的电子式: ,其中的阳离子与阴离子的个数比是 ;
(5)F的固态氧化物的用途有________ ___(说出一种)。F的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的两种化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用),其反应的化学方程式是 。
查看答案和解析>>
科目: 来源:2013届福建省高二下学期期末考试化学试卷(解析版) 题型:填空题
(10分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
|
a |
|
|
|||||||||||||||
|
b |
|
|
|
c |
d |
e |
f |
|
|||||||||
|
g |
h |
i |
j |
|
k |
l |
m |
||||||||||
|
n |
|
|
|
|
|
|
o |
|
|
|
|
|
|
|
|
|
|
试回答下列问题:
(1)表中第一电离能最小的是 (填字母,下同),第一电离能最大的是 。c、d、e三种元素的第一电离能由大到小的顺序是 ,它们与a元素形成的最简单化合物的热稳定性由强到弱的是 (填化学式)。
(2)第三周期中由电负性最大的元素与电负性最小的元素组成的化合物化学式是 。
(3)表中基态原子的未成对电子数最多的元素是 ,其二价阳离子的外围电子排布式是 。
(4)写出由a、d、e三种元素组成的一种离子化合物的化学式 ,并用离子方程式来说明其水溶液显酸性的原因 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com