
科目: 来源:2014届河南省高一下学期期中考试化学试卷(解析版) 题型:选择题
对于敞口容器中的反应:Zn(s)+H2SO4(aq)= ZnSO4 (aq)+H2(g), 反应过程中能量关系可用右图表示,下列叙述中不正确的是 ( )
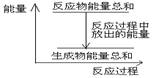
A.1 molZn的能量高于1 molH2的能量
B.反应物Zn和H2SO4的总能量高于产物 ZnSO4和H2的总能量
C.如果Zn足量,反应速率会经历由慢到快到慢的过程
D.用锌粉代替锌粒,速率会加快
查看答案和解析>>
科目: 来源:2014届河南省高一下学期期中考试化学试卷(解析版) 题型:选择题
在四个不同容器中,不同条件下进行合成氨反应。根据在相同时间内测定的结果判断生成氨的速率最快的是:( )
A.V(N2)=0.1mol·L-1·S-1 B.V(H2)=0.1mol·L-1·min-1
C.V(NH3)=0.15mol·L-1·min-1 D.V(H2)=0.3mol·L-1·min-1
查看答案和解析>>
科目: 来源:2014届河南省高一下学期期中考试化学试卷(解析版) 题型:选择题
下表给出了X、Y、Z、W四种短周期元素的部分信息,请根据这些信息判断下列说法中正确的是:( )
|
元素 |
X |
Y |
Z |
W |
|
原子半径(nm) |
0.102 |
0.130 |
0.073 |
0.071 |
|
最高正价或最低负价 |
+6 |
+2 |
-2 |
-1,W无正价 |
A.HW水溶液可以保存在玻璃瓶中 B.X的单质与Z的单质反应生成XZ3
C.Z的最高正价为+6 D.原子序数X>Y>W>Z
查看答案和解析>>
科目: 来源:2014届河南省高一下学期期中考试化学试卷(解析版) 题型:选择题
在元素周期表中位于金属元素和非金属元素交界处最容易找到的材料是
A.制催化剂的材料 B.耐高温、耐腐蚀的合金材料
C.制农药的材料 D.半导体材料
查看答案和解析>>
科目: 来源:2014届河南省高一下学期期中考试化学试卷(解析版) 题型:选择题
假设某化学反应的反应过程如下图表示:( )

观察分析,符合图中变化的化学反应为
A.
A2+3B2 2AB3
B. 2AB2+B2
2AB3
B. 2AB2+B2 2AB3
2AB3
C. 2A2B+5B2 =4AB3 D. 2AB2+B2 = 2AB3
查看答案和解析>>
科目: 来源:2014届河南省高一下学期期中考试化学试卷(解析版) 题型:填空题
(16分)Ⅰ.下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的某性质)


把与下面元素有关性质相符的曲线标号填入相应括号中:
⑴ⅡA族元素的最外层电子数 ( ) ⑵第三周期元素的最高化合价 ( )
⑶第三周期离子Na+、Mg2+、Al3+、P3-、S2-、Cl-的离子半径( )
⑷第二、三周期元素随原子序数递增原子半径的变化(不包括惰性气体) ( )
⑸碱金属的阳离子氧化能力(不包括钫)( )
Ⅱ.下图是元素周期表的一部分
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
⑴请在表中画出金属与非金属的交界线 ⑵请在表中标出第VIII的位置
⑶在表中标出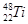 的位置
的位置
查看答案和解析>>
科目: 来源:2014届河南省高一下学期期中考试化学试卷(解析版) 题型:实验题
(13分)四氯化硅是粗硅精炼中的中间产物,熔点-70℃,沸点57.6℃,在潮湿空气中水解生成硅酸和氯化氢。某兴趣小组在实验室里通过下图所示装置制取少量四氯化硅:
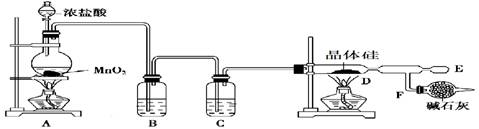
如何检验上图气体发生装置的气密性: ______________________
A装置中发生反应的离子方程式为: ________________________
A装置中玻璃实验仪器名称为(写出两种即可):_______和_______
B中的液体为:______________F中碱石灰的作用为:① __________②________
先加热图中哪个装置:__________________原因:________________________
若实验中用12mol·L-1浓盐酸10mL与足量的MnO2反应,生成Cl2的物质的量
总是小于0.03mol,试分析可能存在的原因是:① __________② _________
查看答案和解析>>
科目: 来源:2014届河南省高一下学期期中考试化学试卷(解析版) 题型:填空题
(11分)Ⅰ.下列各项分别与哪个影响化学反应速率因素的关系最为密切?
⑴夏天的食品易变霉,在冬天不易发生该现象_________
⑵同浓度不同体积的盐酸中放入同样大小的锌块和镁块,产生气体有快有慢
⑶MnO2加入双氧水中放出气泡更快______________。
Ⅱ.在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示:

⑴比较t2时刻,正逆反应速率大小V正____ V逆。(填“>”、“=”、“<”)
⑵若t2 =2min,计算反应开始至t2时刻,M的平均化学反应速率为:________
⑶t3时刻化学反应达到平衡时反应物的转化率为_________
⑷如果升高温度则V逆____(填增大、减小或不变)
查看答案和解析>>
科目: 来源:2014届河南省高一下学期期中考试化学试卷(解析版) 题型:填空题
(12分)A、B、C、D、E是五种短周期元素。已知:它们的原子序数依次增大,A是元素周期表中原子半径最小的元素;B原子最外层电子数比其次外层电子数多2,C是E的邻族元素;D和E的原子序数之和为30,且D的族序数与周期数相等。甲、乙、丙、丁是它们两两形成的化合物,其中甲分子中含有18个电子。
|
物质组成 |
甲 |
乙 |
丙 |
丁 |
|
化合物中各元素 原子个数比 |
A和C 1:1 |
B和A 1:4 |
D和E 1:3 |
B和E 1:4 |
请回答下列问题:
⑴C的氢化物与乙相比较,稳定性强弱关系(用相应的化学式表示): _____>___
⑵元素E在周期表中的位置为第 周期 族
⑶请写出两种与乙具有相同电子数的非单核离子的化学式:_____和_____
⑷把D的单质放到NaOH溶液中,反应的化学方程式为:______________________
⑸写出甲的电子式:________________
⑹有200mL MgCl2和丙的混合溶液,其中c(Mg2+)= 0.2 mol· L-1,c(Cl-)= 1.3 mol·L-1,要使Mg2+全部转化为沉淀分离出来,至少需要4 mol·L-1 NaOH 溶液的体积是: _____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com