
科目: 来源:2013届河北省迁安市高二第一学期期中考试化学试卷(解析版) 题型:选择题
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g)
 2NH3(g),ΔH<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g),ΔH<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
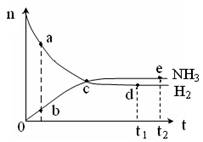
A.点a的n(H2)和点b的n(NH3)比值为3:2
B.点 c处反应达到平衡
C.点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大
查看答案和解析>>
科目: 来源:2013届河北省迁安市高二第一学期期中考试化学试卷(解析版) 题型:选择题
一定条件下,在体积为10 L的密闭容器中,1 mol X和1
mol Y进行反应:2X(g)+Y(g)  Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是
Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是
A.达到平衡时X浓度为0.04 mol/L
B.将容器体积变为20 L,Z的平衡浓度变为0.015mol/L
C.若增大压强,平衡向正方向移动,平衡常数变大
D.若升高温度,X的体积分数增大,则该反应的DH>0
查看答案和解析>>
科目: 来源:2013届河北省迁安市高二第一学期期中考试化学试卷(解析版) 题型:填空题
(12分)⑴已知甲醇在常温下为液体,其热值为22.7kJ•g-1,则甲醇的标准燃烧热的热化学方程式为_______________________________________________。
⑵将甲醇、氧气和氢氧化钾溶液设计成燃料电池,该电池正极反应式为
____________________________________。
⑶右图为工业上氯碱工业的电解槽示意图,据图回答:
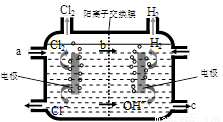
①图中a、b、c处物质名称分别是: a_________________;b________________;c___________________。
②若没有阳离子交换膜,则电解一段时间后在电解槽的溶液中可能发生的化学反应方程式为__________________________。
⑷反应2A 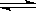 B+C
在某一温度时达到平衡。
B+C
在某一温度时达到平衡。
①若温度升高,平衡向正反应方向移动,则正反应是__________热反应;
②若B为固体,降低压强平衡向逆反应方向移动,则A呈____________态;
③若A是气态时,加压时,平衡不移动,则B为_________态,C为________态。
查看答案和解析>>
科目: 来源:2013届河北省迁安市高二第一学期期中考试化学试卷(解析版) 题型:填空题
(9分)认真观察下列装置,回答下列问题:
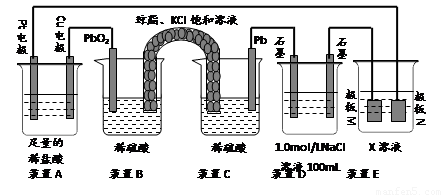
⑴装置B中PbO2上发生的电极反应方程式为 。
⑵装置A中总反应的离子方程式为 。
⑶若装置E中的目的是在Cu材料上镀银,则X为 ,极板N的材料为 。
若装置E的目的是验证金属的电化学防腐,则极板N的材料为__________________ 。
⑷当装置A中Cu电极质量改变6 .4g时,装置D中产生的气体体积为 L(标准状况下)。
查看答案和解析>>
科目: 来源:2013届河北省迁安市高二第一学期期中考试化学试卷(解析版) 题型:计算题
(9分)研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
⑴NO2可用水吸收,相应的化学反应方程式为____________________________。利用反应6NO2+ 8NH3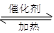 7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是
L。
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是
L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= 。
查看答案和解析>>
科目: 来源:2013届河北省迁安市高二第一学期期中考试化学试卷(解析版) 题型:实验题
(14分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题。

图1 图2
⑴取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中。足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示。
①请在图3 的方框中画出上述反应的速率与时间的关系曲线。

图3
②在前4min内,镁条与盐酸的反应速率逐渐加快,在4min之后,反应速率逐渐减慢,请简述其原因:___________________________________________________________
__________________________________________________________________________。
(2)某同学发现,纯度、质量、表面积都相同的两铝片与H+浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝和盐酸反应速率更快。他决定对其原因进行探究。填写下列空白:
①该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO2- 4对反应没有影响;
原因Ⅱ:Cl-对反应没有影响,而SO2- 4对反应具有阻碍作用;
原因Ⅲ:____________________________________________________;
原因Ⅳ:Cl-、SO2- 4均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:________________________________________________________。
②该同学设计并进行了两组实验,即得出了正确结论。他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
a.在盛有硫酸的试管中加入少量NaCl或KCl固体 ,观察反应速率是否变化;
b.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。
若观察到实验a中_________________________,实验b中________________________,则说明原因Ⅰ是正确的。依次类推。该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用。
查看答案和解析>>
科目: 来源:2013届河北省迁安市高二第一学期期中考试化学试卷(解析版) 题型:计算题
在一定温度下有甲、乙两容积相等的密闭容器(两容器容积保持不变)。
(1)向甲容器中通入3 mol N2和4 mol H2,反应达到平衡时,生成NH3 amol。此时,NH3的物质的量分数是________。(用含有“a”的表达式表示)。若在达到平衡状态的甲容器中通入少量的N2,则达到新平衡时,体系中N2的体积分数将________(选填“增大”、“减小”或“不变”)。
(2) 若起始时,向乙中通入6mol N2和8mol H2,达到平衡时,生成的NH3的物质的量为b mol, (选填“>”、“<”或“=”)。
查看答案和解析>>
科目: 来源:2013届河南周口重点高中四校高二下学期第一次联考化学卷(解析版) 题型:选择题
醋酸是电解质,下列事实能说明醋酸是弱电解质的组合是
①醋酸与水能以任意比互溶 ②醋酸溶液能导电
③醋酸溶液中存在醋酸分子④0.1 mol·L-1醋酸的pH比0.1 mol·L-1盐酸pH大
⑤醋酸能和碳酸钙反应放出CO2 ⑥0.1 mol·L-1醋酸钠溶液pH=8.9
⑦大小相同的锌粒与相同物质的量浓度的盐酸和醋酸反应,醋酸产生H2速率慢
A.②⑥⑦ B.③④⑤⑥ C.③④⑥⑦ D.①②
查看答案和解析>>
科目: 来源:2013届河南周口重点高中四校高二下学期第一次联考化学卷(解析版) 题型:选择题
下列说法正确的是
A.乙烯、苯乙烯、氯乙烯、聚乙烯均能与溴水发生加成反应
B.乙烷、乙酸、乙酸乙酯、油酯均能与氢氧化鈉溶液发生反应
C.向某有机物中加入溴水振荡后,溴水层褪色,说明该有机物能与溴水发生加成反应
D.乙醇与鈉的反应比水与鈉反应平缓得多,说明乙醇羟基中的氢原子不如水分子中的氢原子活泼
查看答案和解析>>
科目: 来源:2013届河南周口重点高中四校高二下学期第一次联考化学卷(解析版) 题型:选择题
某一密闭绝热容器中盛有饱和Ca(OH)2溶液,当加入少量CaO粉末,下列说法正确的是
①有晶体析出 ②c[Ca(OH)2]增大 ③pH不变
④c(H+)·c(OH)-的积不变 ⑤c(H+)一定增大
A.① B.①⑤ C.①②④ D.①③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com