
科目: 来源:2013届河北省高二上学期期中考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在制定溶液中一定能大量共存的是
A.1.0mol/L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-
B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-
C.pH=12的溶液:K+、Na+、CH3COO-、Br-
D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3-
查看答案和解析>>
科目: 来源:2013届河北省高二上学期期中考试化学试卷(解析版) 题型:选择题
某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素
A. 在自然界中只以化合态的形式存在 B. 单质常用作半导体材料和光导纤维
C. 最高价氧化物不与任何酸反应 D. 气态氢化物比甲烷稳定
查看答案和解析>>
科目: 来源:2013届河北省高二上学期期中考试化学试卷(解析版) 题型:填空题
(4分)(1)t℃时,测得纯水中c(OH-)=2×10-7mol·L-1, 则t 25℃(填“>”、“<”或“=”),该温度下,水的离子积常数为 ;
(2)25℃时,某K2SO4溶液中c(SO42-)=1×10-4mol·L-1,取该溶液1mL加水稀释至100mL,则稀释后的溶液中c(K+): c(H+)= ;
(3)已知H2(g)+Cl2(g)=2HCl(g) △H=-184.6 kJ/mol;则反应1/2H2(g)+1/2Cl2(g)=HCl(g) 的△H为
查看答案和解析>>
科目: 来源:2013届河北省高二上学期期中考试化学试卷(解析版) 题型:填空题
(8分)(1)已知25℃时弱电解质电离平衡常数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13。25℃时,将20mL 0.10 mol·L-1 CH3COOH溶液和20mL 0.10 mol·L-1HSCN溶液分别与20mL 0.10 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为:
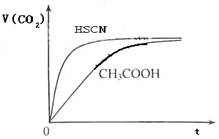
反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 ,
反应结束后所得两溶液中,c(CH3COO-) c(SCN-)(填“>”、“<”或“=”)
(2)25℃时,将pH=1的H2SO4溶液a mL与pH=12的NaOH溶液b mL混合后,所得溶液的pH=3,则a:b= ;反应后,溶液中各离子浓度由大到小的顺序是 。
查看答案和解析>>
科目: 来源:2013届河北省高二上学期期中考试化学试卷(解析版) 题型:填空题
(10分)研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为
。利用反应6NO2+ 8NH3 7N5+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是
7N5+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是
L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g)
ΔH=-113.0 kJ·mol-1
2NO2(g)
ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=
kJ·mol-1。
SO3(g)+NO(g)的ΔH=
kJ·mol-1。
一定条件下,将NO2与SO2以体积比1: 2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= 。
查看答案和解析>>
科目: 来源:2013届河北省高二上学期期中考试化学试卷(解析版) 题型:填空题
(8分)学习化学应该明确“从生活中来,到生活中去”道理。在生产生活中,我们会遇到各种各样的化学反应。
(1)请你写出发酵粉中的主要钠盐的化学式______________。
(2)工业上用氯气和消石灰(氢氧化钙乳浊液)反应制取漂白粉(主要成分是氯化钙和次氯酸钙)请写出其反应的化学方程式 。
(3)请你写出下列反应的离子方程式。
胃舒平含有氢氧化铝,可用来治疗胃酸(盐酸)过多 。
将铁加入硫酸铜溶液中炼铜(湿法炼铜) 。
查看答案和解析>>
科目: 来源:2013届河北省高二上学期期中考试化学试卷(解析版) 题型:实验题
(14分)纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
制备纳米TiO2的方法之一是TiCl4水解生成TiO2·x H2O,经过滤、水洗除去其中的Cl-- ,再烘干、焙烧除去水分得到粉体TiO2 。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+ ,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
(1)TiCl4水解生成TiO2·x H2O的化学方程式为_______________________________。
(2)检验TiO2·x H2O中Cl-是否被除净的方法是______________________________。
(3)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是_________________;
使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的_____(填字母代号)。
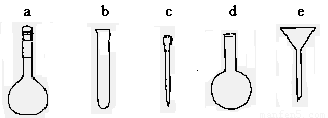
(4)滴定终点的现象是___________________________________________________。
(5)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果__________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果_________。
查看答案和解析>>
科目: 来源:2013届河北省高二上学期期中考试化学试卷(解析版) 题型:推断题
(6分)四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
|
X |
Y |
|
|
|
Z |
W |
请回答下列问题:
(1)元素Z位于周期表中第______________周期,___________族;
(2)这些元素的氢化物中,水溶液碱性最强的是_______________(写化学式);
(3)XW2的电子式为_______________;
(4)Y的最高价氧化物的化学式为________________;
(5)W和Y形成的一种二元化合物具有色温效应,请相对分子质量在170~190之间,且W的质量分数约为70%。该化合物的化学式为_________________。
查看答案和解析>>
科目: 来源:2013届河北省高二第二学期升级考试化学试卷(解析版) 题型:选择题
诗句“春蚕到死丝方尽,蜡炬成灰泪始干”中“丝”和“泪”分别指( )
A.纤维素、油脂 B.蛋白质、油脂
C.淀粉、油脂 D.蛋白质、烃类
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com