
科目: 来源:2011-2012学年浙江省高三5月模拟测试理科综合化学试卷(解析版) 题型:填空题
(14分)A~I九种有机物有如下转化关系:

已知:R1CHOHCHOHR2 + HIO4—→R1CHO+ R2CHO+HIO3 +H2O;又知C的苯环上的一氯代物有2种。请回答下列问题:
(1)写出下列物质的结构简式:A ;I ; C中的官能团名称 ,其核磁共振氢谱图中有 峰。
(2)由H生成G的有机反应类型为 。
(3)写出实现下列转化反应的化学方程式D→B , F→E反应的化学方程式 。
(4)化合物C的同分异构体甚多,写出满足下列条件的所有芳香族同分异构体的结构简式
① 属于对位二取代苯 ② 能发生银镜反应 ③在NaOH溶液中可发生水解反应
。
查看答案和解析>>
科目: 来源:2011-2012学年浙江省高三5月模拟考试理科综合化学试卷(解析版) 题型:选择题
下列说法正确的是
A、谷氨酸(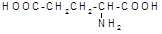 )的熔点高达205℃,主要是因为晶体中羧基与氨基之间形成较强的氢键
)的熔点高达205℃,主要是因为晶体中羧基与氨基之间形成较强的氢键
B、肌红蛋白、牛胰岛素、蚕丝、过氧化氢酶、人造奶油充分水解后均可得到氨基酸
C、氢键、分子间作用力、离子键和共价键均为微粒间的相互作用力
D、李比希燃烧法、钠熔法、铜丝燃烧法、纸层析法都是元素定性分析法
查看答案和解析>>
科目: 来源:2011-2012学年浙江省高三5月模拟考试理科综合化学试卷(解析版) 题型:选择题
下列说法正确的是
A、欲分离硝酸钾和氯化钠的混合物(物质的量比为1:1),先将样品溶解,然后加热至表面出现晶膜后冷却,过滤得硝酸钾晶体;将母液加热至大量晶体析出后,用余热蒸干,得氯化钠晶体
B、摘下几根火柴头,浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸,若出现白色沉淀,说明含氯元素
C、实验室制取肥皂:将适量植物油、乙醇和NaOH溶液混合,并不断搅拌、加热,直到混合物变稠,即可得到肥皂
D、在氯化钴溶液中,四氯合钴(Ⅱ)离子与六水合钴(Ⅱ)离子存在着平衡,将溶液稀释时,溶液的颜色由蓝色逐渐转变为粉红色
查看答案和解析>>
科目: 来源:2011-2012学年浙江省高三5月模拟考试理科综合化学试卷(解析版) 题型:选择题
aA、bB、cC、dD、eE五种短周期元素,它们的原子序数有如下关系:c-b=b-a=1且 b+c=d,常见化合物E2C2与水反应生成C的单质,且溶液使酚酞试液变红。B的最高价氧化物对应水化物为强酸。下列说法正确的是
A、B与D形成的单质分别为甲、乙,非金属性:B>D,活泼性:乙>甲
B、1molE2C2与足量水完全反应生成C的单质,共转移电子2mol
C、原子半径:D>E>A>B>C
D、C的氢化物的沸点低于B的氢化物的沸点
查看答案和解析>>
科目: 来源:2011-2012学年浙江省高三5月模拟考试理科综合化学试卷(解析版) 题型:选择题
来自法国格勒诺布尔(Grenoble)约瑟夫·傅立叶大学的研究小组发明了第一块可为人体人造器官提供电能的可植入的葡萄糖生物燃料电池,其基本原理是葡萄糖和氧气在人体中酶的作用下发生的总反应为C6H12O6+6O2=6CO2+6H2O(酸性环境),下列对该电池说法不正确的是
A、该生物燃料电池不可以在高温下工作
B、电池的负极反应为:C6H12O6+6H2O-24e-=6CO2+24H+
C、消耗1mol氧气则转移4mole-,H+会向负极移动
D、今后的研究方向是怎样提高葡萄糖生物燃料电池的效率,从而在将来达到可以利用葡萄糖生物燃料电池为任何可植入医疗设备提供电能
查看答案和解析>>
科目: 来源:2011-2012学年浙江省高三5月模拟考试理科综合化学试卷(解析版) 题型:选择题
下列说法正确的是
A、按照系统命名法,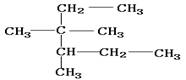 的名称为3,3—二甲基—2—乙基戊烷
的名称为3,3—二甲基—2—乙基戊烷
B、乙醇、乙酸和乙酸乙酯不能用饱和Na2CO3溶液鉴别
C、桶烯(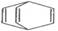 )与苯乙烯
)与苯乙烯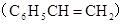 互为同分异构体,均属于芳香烃
互为同分异构体,均属于芳香烃
D、1.0mol的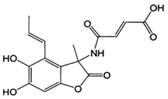 与NaOH溶液和H2反应时,分别需要消耗NaOH 6.0mol和H2 5.0mol
与NaOH溶液和H2反应时,分别需要消耗NaOH 6.0mol和H2 5.0mol
查看答案和解析>>
科目: 来源:2011-2012学年浙江省高三5月模拟考试理科综合化学试卷(解析版) 题型:选择题
下列说法正确的是
A、500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: △H=-38.6kJ·mol-1
△H=-38.6kJ·mol-1
B、10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:c(Cl-)>c(CH3COOH) >c(Na+)>c(H+)>c(OH-)
C、实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键
D、在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl—)。用含a的代数式表示NH3·H2O的电离常数Kb=
查看答案和解析>>
科目: 来源:2011-2012学年浙江省高三5月模拟考试理科综合化学试卷(解析版) 题型:选择题
定量分析中可用AgNO3溶液滴定Cl-溶液,加入K2CrO4为指示剂,达到滴定终点时溶液体积为50mL,c(Cl-) = 10-5 mol·L-1,AgNO3与CrO42- 生成砖红色的Ag2CrO4沉淀。已知Ksp(AgCl) = 1.77×10-10, Ksp(AgI) = 8.51×10-17,Ksp(Ag2CrO4) = 1.12×10-12,根据以上实验操作和有关数据,下列说法正确的是
A.常温下,向含AgCl固体的AgCl溶液中加入NaCl固体,AgCl沉淀的量不变
B.滴定终点时,溶液中CrO42-的浓度约为3.6×10-3 mol·L-1
C.向10mL0.1moL/L AgNO3溶液中滴加3—5滴0.1moL/L NaCl溶液生成AgCl沉淀,再滴加KI溶液,生成AgI沉淀,能够说明Ksp(AgI)< Ksp(AgCl)
D.可用0.1 mol·L-1的KI溶液代替K2CrO4做指示剂
查看答案和解析>>
科目: 来源:2011-2012学年浙江省高三5月模拟考试理科综合化学试卷(解析版) 题型:填空题
(14分)已知A、B、C、D、E为中学化学常见的五种物质,均含元素R,R在A、B、C、D、E中所呈化合价依次递增,其中只有B为单质。常温下,A、B、C、D为气体,且D+H2O→C+E。
请回答下列问题:
⑴元素R在元素周期表中的位置为_________ ____; B分子的电子式为__________。
⑵已知气体D与NaOH溶液1:1恰好完全反应,生成R的两种含氧酸盐,所得溶液中各离子浓度大小关系 。
⑶将22.4L某R的氧化物与足量的灼热铜粉完全反应后,气体体积变为11.2L(体积均在相同条件下测定),则该氧化物的化学式可能为 。(填序号)
①、RO2 ②、R2O3 ③、RO ④、R2O
⑷科学家制备的另一种化合物,与A的组成元素相同,具有很高的热值,可用作火箭和燃料电池的燃料。该化合物可由次氯酸钠溶液和A反应得到,写出该反应的化学方程式 。
⑸M为E的钠盐,一定条件下可发生如下反应:

①设计实验方案,鉴定常见物质N 。
②此外,科学家还制备了另一种钠盐X,其与P的组成元素完全相同,X中的阴离子与P中的阴离子表观形式相同(元素种类和原子个数均相同),但X中阴离子的结构中含有一个过氧键:-O-O- ,电导实验表明,同条件下其电导能力与NaCl相同,钠盐X的阴离子与水反应生成过氧化氢的离子方程式为 。
|
25℃平衡体系(苯、水、HA) |
平衡常数 |
焓变 |
起始总浓度 |
|
在水中,HA |
K1 |
△H1 |
3.0×10-3 mol·L-1 |
|
在苯中,2HA |
K2 |
△H2 |
4.0×10-3 mol·L-1 |
查看答案和解析>>
科目: 来源:2011-2012学年浙江省高三5月模拟考试理科综合化学试卷(解析版) 题型:填空题
(15分)某研究小组对一元有机弱酸HA在溶剂苯和水的混合体系中溶解程度进行研究。在25℃时,弱酸HA在水中部分电离,HA的电离度为0.10;在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1∶1;已知:lg2=0.3,lg3=0.5 其他信息如下:
|
25℃平衡体系(苯、水、HA) |
平衡常数 |
焓变 |
起始总浓度 |
|
在水中,HA === H++A- |
K1 |
△H1 |
3.0×10-3 mol·L-1 |
|
在苯中,2HA == (HA)2 |
K2 |
△H2 |
4.0×10-3 mol·L-1 |
回答下列问题:
(1)计算25℃时水溶液中HA的电离平衡常数K1= 。
(2)25℃,该水溶液的pH为 ,在苯体系中HA的转化率为__________。
(3)25℃混合体系中,HA在苯中发生二聚,若测得某时刻溶液中微粒浓度满足 ,则反应向_______方向进行。
,则反应向_______方向进行。
(4)在苯中,HA自发进行发生二聚:2HA (HA)2, 已知该二聚反应的反应热数值约为活化能的5/9 。下列能量关系图最合理的是
。
(HA)2, 已知该二聚反应的反应热数值约为活化能的5/9 。下列能量关系图最合理的是
。

(5)下列有关该混合体系说法不正确的是 。
A.用分液漏斗分离得到水溶液和苯溶液,若水溶液中加入少量水,苯溶液中加少量苯,则上述平衡均正移,且c(HA)均减小。
B.升高温度,HA的电离平衡常数K1和2HA  (HA)2的平衡常数K2均变大。
(HA)2的平衡常数K2均变大。
C.若用酸碱中和滴定的分析方法,可以测出HA的起始总浓度。
D.在25℃时,若再加入一定量的HA固体,则水和苯中HA的起始总浓度之比仍为3:4。
(6)在25℃时,用0.1000mol/L氢氧化钠溶液滴定20.00mL 0.1000mol/L HA水溶液,请在下图中画出滴定曲线示意图。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com