
科目: 来源:2011-2012学年浙江省高三5月模拟测试理科综合化学试卷(解析版) 题型:选择题
化学与人类生活、社会可持续发展密切相关,下列说法正确的是
A.“天宫一号”中使用的碳纤维,是一种纤维素
B.回收制革工厂的边角皮料生产食用明胶,加工成医用胶囊或做食品增稠剂
C.氯化汞(HgCl2)的稀溶液可用于手术器械消毒,因为它会使蛋白质变性,杀菌消毒
D.蛋白质、淀粉、纤维素、油脂、葡萄糖等都能在人体内水解并提供能量
查看答案和解析>>
科目: 来源:2011-2012学年浙江省高三5月模拟测试理科综合化学试卷(解析版) 题型:选择题
下列说法正确的是
A.乙醇和二甲醚(CH3-O-CH3)是同分异构体,其鉴别可采用物理或化学方法。李比希法、质谱法、红外光谱法、核磁共振氢谱法均能对二者进行鉴别
B.在装有3ml0.5mol·L-1CoCl2 溶液的试管中,慢慢滴加浓盐酸,溶液的颜色由粉红色逐渐变为蓝色
C.阿司匹林制备实验中,将粗产品加入饱和NaOH溶液中以除去水杨酸聚合物
D.减压过滤不宜用于过滤胶状沉淀或颗粒太小的沉淀,因为胶状沉淀和颗粒太小的沉淀快速过滤时易透过滤纸
查看答案和解析>>
科目: 来源:2011-2012学年浙江省高三5月模拟测试理科综合化学试卷(解析版) 题型:选择题
将2molCO2和6molH2充入容积为3L的密闭容器中,在一定温度和压强条件下发生了下列反应:CO2(g)+3H2
(g) CH3OH(g)+H2O(g)
ΔH=- 49.0 kJ·mol-1。反应达到平衡时,改变温度(T)和压强(P),反应混合物中CH3OH的“物质的量分数”变化情况如图所示,关于温度(T)和压强(P)的关系判断正确的是
CH3OH(g)+H2O(g)
ΔH=- 49.0 kJ·mol-1。反应达到平衡时,改变温度(T)和压强(P),反应混合物中CH3OH的“物质的量分数”变化情况如图所示,关于温度(T)和压强(P)的关系判断正确的是
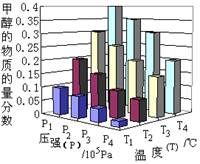
A.P3>P2 T3>T2
B.P2>P4 T4>T2
C.P1>P3 T3>T1
D.P1>P4 T2>T3
查看答案和解析>>
科目: 来源:2011-2012学年浙江省高三5月模拟测试理科综合化学试卷(解析版) 题型:选择题
下列说法正确的是
A.有机物( )的名称为
2—甲基丙醇
)的名称为
2—甲基丙醇
B.芥子醇( 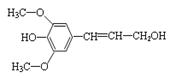 )
能发生氧化、取代、水解、加聚反应
)
能发生氧化、取代、水解、加聚反应
C.1 mol绿原酸(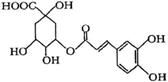 )与足量溴水反应,最多消耗4molBr2
)与足量溴水反应,最多消耗4molBr2
D.有机物(俗称“一滴香”)(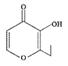 )的一种含苯环的同分异构体能发生银镜反应
)的一种含苯环的同分异构体能发生银镜反应
查看答案和解析>>
科目: 来源:2011-2012学年浙江省高三5月模拟测试理科综合化学试卷(解析版) 题型:选择题
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。下列正确的是:
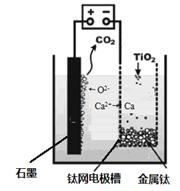
A.由TiO2制得1mol 金属Ti ,理论上外电路转移2NA电子
B.阳极的电极反应式为:C + 2O2- - 4e- == CO2↑
C.若用铅蓄电池作该装置的供电电源,“ +”接线柱应连接Pb电极
D.在制备金属钛前后,整套装置中CaO的总量减少
查看答案和解析>>
科目: 来源:2011-2012学年浙江省高三5月模拟测试理科综合化学试卷(解析版) 题型:选择题
甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、Cl-、HCO3-、OH-、H+、SO42-中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其它三种物质的溶液混合,均有白色沉淀生成;② 0.1 mol/L乙溶液中c(H+)>0.1 mol/L;③ 向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。下列结论不正确的是
A. 甲溶液含有Ba2+ B. 乙溶液含有SO42-
C丙溶液含有Cl- D.丁溶液含有Mg2+
查看答案和解析>>
科目: 来源:2011-2012学年浙江省高三5月模拟测试理科综合化学试卷(解析版) 题型:选择题
常温度下,将Cl2缓慢通入水中至饱和,然后再滴加0.1mol/L的NaOH溶液,整个过程中 溶液的pH变化曲线如图所示。下列选项正确的是

A. a点所示的溶液中
B. b点所示的溶液中
C. c点所示的溶液中
D. d点所示的溶液中
查看答案和解析>>
科目: 来源:2011-2012学年浙江省高三5月模拟测试理科综合化学试卷(解析版) 题型:填空题
(14分)铁是一种过渡元素,金属铁是最常用的金属。请回答下列各题:
(1)生铁中含有一种铁碳化合物(Fe3C),在足量的空气中高温煅烧,生成有磁性的固体和能使澄清石灰水变浑浊的气体,该反应的化学方程式为 。上述反应生成的磁性固体能溶于过量盐酸,该反应的离子方程式为 。
(2)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化。已知,含SO2的废气通入Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为 。
(3)硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制绿矾。利用烧渣制绿矾的过程如下:

①烧渣溶于稀H2SO4过程中,有单质硫生成,写出该反应的离子方程式(只写生成S的反应式,其他反应无需写出) 。
②向溶液X中加入足量铁屑的目的是 。
③可用硫酸酸化的 KMnO4溶液通过滴定法测定绿矾产品中FeSO4含量,滴定时发生反应的离子方程式为 。
(4)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH=3时,通过计算说明Fe3+是否沉淀完全 。
(提示:当某离子浓度小于1.0×10-5 mol•L-1时可以认为该离子沉淀完全了)
查看答案和解析>>
科目: 来源:2011-2012学年浙江省高三5月模拟测试理科综合化学试卷(解析版) 题型:填空题
(15分)随着氮氧化物污染的日趋严重,国家将于“十二五”期间加大对氮氧化物排放的控制力度。目前,消除氮氧化物污染有多种方法。
(1)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2(g)+CO2 (g) △H。某研究小组向某恒容密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2 (g) △H。某研究小组向某恒容密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
|
浓度/mol·L-1 时间/min |
NO |
N2 |
CO2 |
|
0 |
0.100 |
0 |
0 |
|
10 |
0.058 |
0.021 |
0.021 |
|
20 |
0.040 |
0.030 |
0.030 |
|
30 |
0.040 |
0.030 |
0.030 |
|
40 |
0.032 |
0.034 |
0.017 |
|
50 |
0.032 |
0.034 |
0.017 |
①下列各项不能作为判断反应达到化学平衡状态依据的是
A.容器内CO2 的浓度保持不变 B.v正(N2) =2 v正(NO)
C.容器内压强保持不变 D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
②T1℃时,该反应的平衡常数K= (保留两位小数)。
③30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。
④若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H 0(填“>”、“ =”或“<”)。
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
③H2O(g)=H2O(l) △H=-44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式 。
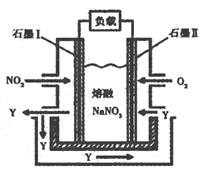
(3)以NO2、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨I电极反应生成一种氧化物Y,有关电极反应可表示为 。
查看答案和解析>>
科目: 来源:2011-2012学年浙江省高三5月模拟测试理科综合化学试卷(解析版) 题型:实验题
(15分)亚硝酸钠是一种工业盐,现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。
已知:①NO+NO2+2OH-=2NO2-+H2O
②气体液化的温度:NO2 21℃、NO -152℃

(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接):
A 、C、 、 、 。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是:
。
(3)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是 。
②装置E的作用是 。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为 。如果没有装置C,对实验结论造成的影响是 。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com