
科目: 来源:2011-2012学年江西省高三第二次联考理综化学试卷(解析版) 题型:选择题
“天宫一号”飞行器在太空工作期间必须有源源不断的电源供应。其供电原理是:白天太阳能帆板发电,将一部分电量直接供给天宫一号,另一部分电量储存在镍氢电池里,供黑夜时使用。镍氢电池放电时的总反应原理为:MH + NiO(OH) → M + Ni(OH)2 (M为氢化物电极的储氢金属,也可看做H2直接参加反应)。下列说法正确的是
A.充电时阴极区电解质溶液pH降低
B.在使用过程中此电池要不断补充水
C.放电时NiO(OH)在电极上发生氧化反应
D.充电时阳极反应为:Ni(OH)2-e-+OH-=NiO(OH)+H2O
查看答案和解析>>
科目: 来源:2011-2012学年江西省高三第二次联考理综化学试卷(解析版) 题型:选择题
下列实验对应的结论不正确的是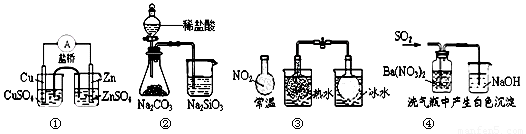
A.①能组成Zn、Cu原电池 B.②能证明非金属性Cl>C>Si
C.③说明反应2NO2
 N2O4,△H<0 D.④白色沉淀为BaSO4
N2O4,△H<0 D.④白色沉淀为BaSO4
查看答案和解析>>
科目: 来源:2011-2012学年江西省高三第二次联考理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.相同物质的量浓度的下列溶液:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O; c(NH4+)由大到小的顺序是:①>②>③>④
B.某溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,则该溶液的pH一定为14-a
C.物质的量浓度相等的 H2S 和 NaHS 混合溶液中:c(Na+) = 2c(S2-) +2c(HS-)+2c(H2S)
D.常温下,若0.1mol/L NaHY溶液的pH=4,该溶液中粒子浓度关系为:c(Na+)>c(HY-)> c(Y2-) > c(H+)> c(H2Y)
查看答案和解析>>
科目: 来源:2011-2012学年江西省高三第二次联考理综化学试卷(解析版) 题型:选择题
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列说法正确的是

A.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+
B.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
C.原溶液中一定含有SO42-和Na+
D.反应最后形成的溶液中溶质只有Na2SO4
查看答案和解析>>
科目: 来源:2011-2012学年江西省高三第二次联考理综化学试卷(解析版) 题型:填空题
(14分) A、B、C、D、E、F为常见的原子序数依次递增短周期元素, B、C、D、E、F的简单离子的电子层结构相同,A和E同主族,且原子的最外层电子数的关系为A+D=B+F=8。请回答:
(1)试写出B2单质的电子式: 。
试写出由上述元素组成的4个原子核构成18电子结构的物质的化学式
(2)含F元素对应的金属阳离子的溶液中滴加过量E的最高价氧化物对应水化物的溶液反应,其离子方程式是 。
(3)已知B2A4与BA3具有相似的性质,B2A4通过炽热的氧化铜粉末,粉末由黑色变为红色,且产物对大气无污染,其化学反应方程式: 。
(4)在2L的密闭容器中,通入2molB2气体和3molA2气体,一定温度下反应生成BA3气体,当反应达到平衡时,A2的浓度为0. 15mol·L-1,同时放出约83.2 kJ的热量,该反应的热化学方程式 。
(5)已知某化合物EB3与水可以反应生成两种气体单质和一种碱,试写出其化学方程式
;若0.1mol该化合物完全反应,转移电子的物质的量为 。
查看答案和解析>>
科目: 来源:2011-2012学年江西省高三第二次联考理综化学试卷(解析版) 题型:填空题
(14分)(1)二氧化硫的催化氧化的过程如图所示,

其中a、c二步的化学方程式可表示为:
SO2+V2O5 SO3+ V2O4
SO3+ V2O4
4VOSO4+O2 2V2O5+4SO3。
2V2O5+4SO3。
该反应的催化剂是 (写化学式)
(2)压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%,O2 11%,N2 82%):
|
压强/MPa 温度/℃ |
0.1[ |
0.5 |
1 |
10 |
|
400 |
99.2% |
99.6% |
99.7% |
99.9% |
|
500 |
93.5% |
96.9% |
97.8% |
99.3% |
|
600 |
73.7% |
85.8% |
89.5% |
96.4% |
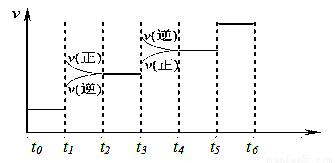
当合成SO3的反应达到平衡后,改变某一外界条件(不改变SO2、O2和SO3的量),反应速率与时间的关系如图所示。图中t1 时引起平衡移动的条件可能是 其中表示平衡混合物中SO3的含量最高的一段时间是 。
(3)550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如右图所示。将2.0
mol SO2和1.0
mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10
M Pa。试计算反应2SO3 2SO2+O2 在550 ℃时的平衡常数K=
。
2SO2+O2 在550 ℃时的平衡常数K=
。

反应达平衡后,下列措施中能使n(SO3)/n(SO2)增大的是
A.升高温度 B.充入He(g),使体系总压强增大
C.再充入2 mol SO2和1 mol O2 D.再充入1 mol SO2和1 mol O2
(4)SO3溶于水得到硫酸。在25°C下,将x mol·L-1的氨水与y mol·L-1的硫酸等体积混合,反应后溶液中显中性,则c(NH4+) 2 c(SO42-)(填“>”、“<”或“=”);用含x和y的代数式表示出氨水的电离平衡常数 。
查看答案和解析>>
科目: 来源:2011-2012学年江西省高三第二次联考理综化学试卷(解析版) 题型:实验题
(15分)Na2O2是常见的氧化剂,某化学小组的同学欲通过以下实验确定炭粉与Na2O2反应的产物。
[实验步骤]
I、按下图所示装置(部分仪器未画出)组装仪器,并检查装置气密性。
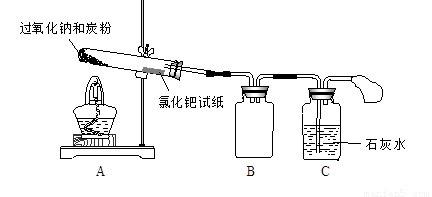
II. 将0.6 g炭粉与3.9 g Na2O2均匀混合,装入试管,在靠近试管口处放置一张湿润的
氯化钯试纸(湿润氯化钯试纸遇CO变黑,可用于检验是否有CO生成)。
III. 用酒精灯微微加热试管底部。
[实验现象]
试管中发生剧烈反应并产生火花,氯化钯试纸未变黑,石灰水未变浑浊。
请回答:
(1)装置B的作用是 。
(2)通过探究发现,装置A中只发生反应2Na2O2+C Na2CO3+X,则X为
(填化学式), ①请设计实验证明产物X的存在,简要写出操作方法、现象和结论:
Na2CO3+X,则X为
(填化学式), ①请设计实验证明产物X的存在,简要写出操作方法、现象和结论:
。
②有人认为炭粉的加入量的多少会影响产物X的检验,请简要说明原因:
(3)CO在潮湿环境中可将氯化钯还原为黑色粉末状的钯(Pd:Mr=106),同时生成另外两种新物质。已知反应过程中转移6.02×1023个电子时,生成53 g Pd,该反应的化学方程式为 。
(4)将装置A中完全反应后所得物质溶于适量水,配成溶液,回答下列问题:
①溶液中下列关系正确的是 (填字母序号)。
a.c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)
b.c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)
c.c(Na+)=2[c(CO32-)+c(HCO3-)+ c(H2CO3)]
d.c(H+)+c(Na+)=c(OH-)+2c(CO32-)+c(HCO3-)
②若使所得溶液与100 mL稀盐酸恰好完全反应至溶液pH=7,该盐酸的物质的量浓度为 。
查看答案和解析>>
科目: 来源:2011-2012学年江西省高三第二次联考理综化学试卷(解析版) 题型:填空题
(15分)甲烷是天然气、沼气、坑气及煤气的主要成分之一,可用作燃料及制造氢、一氧化碳、甲醛等物质的原料,其中用作制氢合成氨的工艺流程示意图如下:
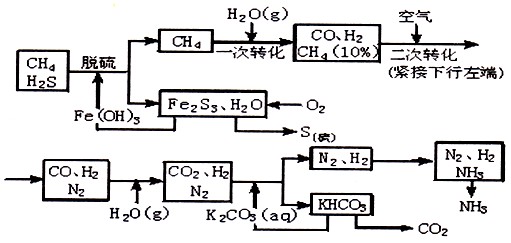
依据上述流程,完成下列填空:
(1)天然气脱硫时的化学方程式是_______________________________。
(2)n mol CH4经一次转化后产生CO 0.9n mol,产生H2_____________mol,假设后面几步转化各物质均完全反应,则理论上可制备得到氨气 mol(用含n的代数式表示)
(3)K2CO3(aq)和CO2反应在加压下进行,加压的理论依据是___________
A.相似相容原理 B.勒夏特列原理 C. 酸碱中和原理
(4)分析流程示意图回答,该合成氨工艺主要起始原料是 ,辅助原料有_________。
(5)整个流程有三处循环,一是Fe(OH)3循环,二是 循环,三是N2、H2循环。
查看答案和解析>>
科目: 来源:2011-2012学年江西省高三第二次联考理综化学试卷(解析版) 题型:填空题
(15分)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
|
电离能(kJ/mol) |
I1 |
I2 |
I3 |
I4 |
|
A |
932 |
1821 |
15390 |
21771 |
|
B |
738 |
1451 |
7733 |
10540 |
(1)某同学根据上述信息,推断B的核外电子排布如右图所示,该同学所画的电子排布图违背了 。
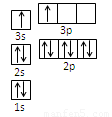
(2)ACl2分子中A的杂化类型为 。
(3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确 ,并阐述理由 。
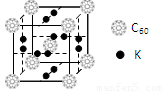
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物, 其晶胞如图所示,该物质在低温时是一种超导体。写出基态钾原子的价电子排布式 ,该物质的K原子和C60分子的个数比为 。
(5)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是 ,NCl3分子的VSEPR模型为 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为 。
查看答案和解析>>
科目: 来源:2011-2012学年江西省高三第二次联考理综化学试卷(解析版) 题型:填空题
(15分)用煤化工产品C8H10合成高分子材料I的路线如下:
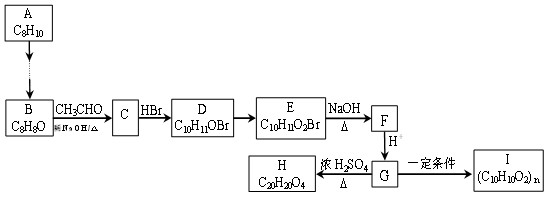
 已知:(1)B、C、D都能发生银镜反应,且苯环上的一卤代物有两种。H含有三个六元环。
已知:(1)B、C、D都能发生银镜反应,且苯环上的一卤代物有两种。H含有三个六元环。
(2)RCHO+R'CH2CHO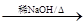 + H2O
+ H2O
根据题意完成下列填空:
(1)A的名称是 ; D中含有官能团的名称 。
(2)D→E的反应类型是 ;
(3)C和H的结构简式分别为 、 。
(4)E→F的化学方程式是 。
(5)G→I的化学方程式是 。
(6)符合下列条件的G的同分异构体有 种,
写出其中任意一种的结构简式
A、能发生银镜反应和水解反应,且1mol该同分异构体能消耗2mol的NaOH
B、含有苯环,但不能与FeCl3显色。
C、不含甲基
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com