
科目: 来源:2011-2012学年江苏省苏中三市高三5月第二次调研测试化学试卷(解析版) 题型:填空题
(12分)酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式。SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下:
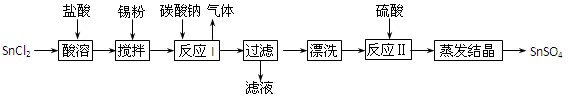
回答下列问题:
⑴SnCl2用盐酸而不用水直接溶解的原因是 ,加入Sn粉的作用是 。
⑵反应I生成的沉淀为SnO,写出该反应的化学方程式: 。
⑶检验沉淀已经“漂洗”干净的方法: 。
⑷反应Ⅱ硫酸的作用之一是控制溶液的pH,若溶液中c(Sn2+)=1.0mol·L—1,则应控制溶液pH 。已知:Ksp[Sn(OH)2]=1.0×10—26。
⑸酸性条件下,SnSO4还可以用作双氧水去除剂,试写出发生反应的离子方程式:
。
查看答案和解析>>
科目: 来源:2011-2012学年江苏省苏中三市高三5月第二次调研测试化学试卷(解析版) 题型:填空题
(15分)有机物G是一种食品香料,其香气强度为普通香料的3~4倍,有机物I的合成路线如下:

已知: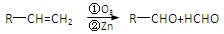
⑴该香料长期暴露于空气中易变质,其原因是 。
⑵写出A中含氧官能团的名称: ,由C到 D的反应类型为 。
⑶有机物E的结构简式为 。
⑷有机物G同时满足下列条件的同分异构体有 种。
①与FeCl3溶液反应显紫色;
②可发生水解反应,其中一种水解产物能发生银镜反应;
③分子中有4种不同化学环境的氢。
⑸写出以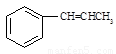 为原料制备
为原料制备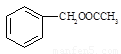 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
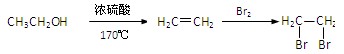
查看答案和解析>>
科目: 来源:2011-2012学年江苏省苏中三市高三5月第二次调研测试化学试卷(解析版) 题型:填空题
(12分)某种铅酸蓄电池具有廉价、长寿命、大容量的特点,它使用的电解质是可溶性的甲基磺酸铅,电池的工作原理:

⑴放电时,正极的电极反应式为 ;充电时,Pb电极应该连接在外接电源的 (填“正极”或“负极”)。
⑵工业用PbO2来制备KClO4的工业流程如下:
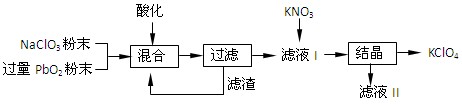
①写出NaClO3与PbO2反应的离子方程式: 。
②工业上可以利用滤液Ⅰ与KNO3发生反应制备KClO4的原因是 。
⑶PbO2会随温度升高逐步分解,称取23.9gPbO2,其受热分解过程中各物质的质量随温度的变化如右图所示。
若在某温度下测得剩余固体的质量为22.94g,则该温度下PbO2分解所得固体产物的组成为 (写化学式),其物质的量之比为 。

查看答案和解析>>
科目: 来源:2011-2012学年江苏省苏中三市高三5月第二次调研测试化学试卷(解析版) 题型:实验题
(15分)碱式碳酸铜的成分有多种,其化学式一般可表示为xCu(OH)2·yCuCO3。
⑴孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2·CuCO3。某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL 0.50 mol·L—1的Cu(NO3)2溶液、2.0mL 0.50 mol·L—1的NaOH溶液和0.25 mol·L—1的Na2CO3溶液按表Ⅰ所示体积混合。
实验2:将合适比例的混合物在表Ⅱ所示温度下反应。
实验记录如下:
|
编号 |
V (Na2CO3)/ mL |
沉淀情况 |
|
编号 |
反应温度/℃ |
沉淀情况 |
|
1 |
2.8 |
多、蓝色 |
|
1 |
40 |
多、蓝色 |
|
2 |
2.4 |
多、蓝色 |
|
2 |
60 |
少、浅绿色 |
|
3 |
2.0 |
较多、绿色 |
|
3 |
75 |
较多、绿色 |
|
4 |
1.6 |
较少、绿色 |
|
4 |
80 |
较多、绿色(少量褐色) |
表Ⅰ 表Ⅱ
①实验室制取少许孔雀石,应该采用的条件是 。
②80℃时,所制得的孔雀石有少量褐色物质的原因是 。
⑵实验小组为测定上述某条件下所制得的碱式碳酸铜样品组成,利用下图所示的装置(夹持仪器省略)进行实验:
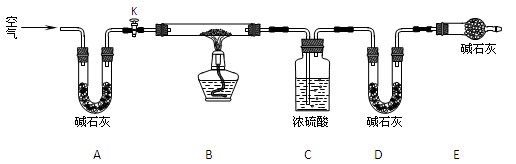
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中。
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量。
步骤3:加热装置B直至装置C中无气泡产生。
步骤4: 。
步骤5:称量相关装置的质量。
①装置A的作用是 ;若无装置E,则实验测定的x/y的值将 (选填“偏大”、“偏小”或“无影响”)。
②某同学在实验过程中采集了如下数据:
A.反应前玻璃管与样品的质量163.8g
B.反应后玻璃管中残留固体质量56.0g
C.装置C实验后增重9.0g
D.装置D实验后增重8.8g
为测定x/y的值,你认为可以选用上述所采集数据中的 (写出所有组合的字母代号)一组即可进行计算,并根据你的计算结果,写出该样品组成的化学式 。
查看答案和解析>>
科目: 来源:2011-2012学年江苏省苏中三市高三5月第二次调研测试化学试卷(解析版) 题型:填空题
(14分)乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:2CO(g)+4H2 (g)  CH3CH2OH(g)+H2O(g)
△H=—256.1kJ·mol—1。
CH3CH2OH(g)+H2O(g)
△H=—256.1kJ·mol—1。
已知:H2O(l)=H2O(g) △H=+44kJ·mol—1
CO(g)+H2O(g) CO2(g)+H2(g)
△H=—41.2kJ·mol—1
CO2(g)+H2(g)
△H=—41.2kJ·mol—1
⑴以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:
2CO2(g)+6H2(g)
 CH3CH2OH(g)+3H2O(l)
△H= 。
CH3CH2OH(g)+3H2O(l)
△H= 。
⑵CH4和H2O(g)在催化剂表面发生反应CH4+H2O CO+3H2,该反应在不同温度下的化学平衡常数如下表:
CO+3H2,该反应在不同温度下的化学平衡常数如下表:
|
温度/℃ |
800 |
1000 |
1200 |
1400 |
|
平衡常数 |
0.45 |
1.92 |
276.5 |
1771.5 |
①该反应是_____反应(填“吸热”或“放热”);
②T℃时,向1L密闭容器中投入1molCH4和1mol H2O(g),平衡时c(CH4)=0.5mol·L—1,该温度下反应CH4+H2O CO+3H2的平衡常数K= 。
CO+3H2的平衡常数K= 。
⑶汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag-ZSM-5 为催化剂,测得NO转化为N2的转化率随温度变化情况如图。
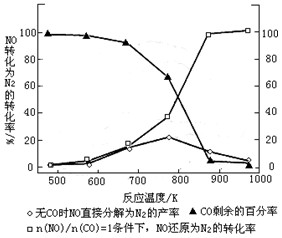
①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为 ;在n(NO)/n(CO)=1的条件下,应控制的最佳温度在 左右。
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染。写出CH4与NO2发生反应的化学方程式: 。
⑷乙醇-空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2—离子。该电池负极的电极反应式为 。
查看答案和解析>>
科目: 来源:2011-2012学年江苏省苏中三市高三5月第二次调研测试化学试卷(解析版) 题型:填空题
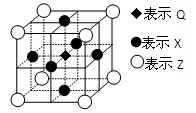
(12分)已知:G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大。G的简单阴离子最外层有2个电子,Q原子最外层电子数是内层电子数的两倍,X元素最外层电子数与最内层电子数相同;T2R的晶体类型是离子晶体,Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于原子晶体;在元素周期表中Z元素位于第10列。
回答下列问题:
⑴Z的核外电子排布式是 。
⑵X以及与X左右相邻的两种元素,其第一电离能由小到大的顺序为 。
⑶QR2分子中,Q原子采取 杂化,写出与QR2互为等电子体的一种分子的化学式: 。[来源:Zxxk.Com]
⑷分子式为Q2G6R的物质有两种,其中一种易溶于水,原因是 ;T的氯化物的熔点比Y的氯化物的熔点高,原因是 。
⑸据报道,由Q、X、Z三种元素形成的一种晶体具有超导性,其晶体结构如图所示。晶体中距每个X原子周围距离最近的Q原子有 个。
查看答案和解析>>
科目: 来源:2011-2012学年江苏省苏中三市高三5月第二次调研测试化学试卷(解析版) 题型:实验题
谷氨酸一钠盐是味精的主要成分,谷氨酸一钠盐在水溶液中存在如下平衡:[来源:]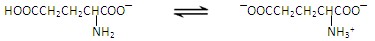
⑴当前我国生产味精主要采用淀粉发酵法,其中第一步是使淀粉水解为单糖。实验室中检验淀粉水解产物可选用的试剂是 。
A.NaOH溶液、氨水、AgNO3溶液 B.H2SO4溶液、氨水、AgNO3溶液
C.NaOH溶液、CuSO4溶液 D.H2SO4溶液、CuSO4溶液
⑵“沙伦逊甲醛滴定法”可用于测定味精中谷氨酸一钠盐的含量。其方法如下:
将一定质量的味精样品溶于水,再向溶液中加入36%甲醛溶液,发生的反应如下:
R—NH2+HCHO→R—N=CH2+H2O(R表示除“-NH2”外的基团),再以酚酞为指示剂,用NaOH溶液进行滴定。
①上述测定过程中加入甲醛的目的是 。
②滴定终点的实验现象为 。
⑶味精中常含食盐,有两个同学分别设计甲、乙两种方案来测定味精中NaCl的含量。
①甲方案:取一定质量味精样品溶于水,加入足量稀硝酸酸化的硝酸银溶液,充分反应后, (填写操作步骤),称量沉淀质量。
②乙方案:取mg味精溶于水,加入过量浓度为c1mol·L—1的AgNO3溶液,再加入少量 溶液做指示剂,用浓度为c2mol·L—1的NH4SCN溶液进行滴定,当溶液变为红色时,达到滴定终点。已知:AgSCN是难溶于水的沉淀。
设测定过程中所消耗的AgNO3溶液和NH4SCN溶液的体积分别为V1mL和V2mL,则该味精样品中NaCl的质量分数是 。
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列对化学反应的认识,不正确的是
A.化学反应必然引起物质状态的变化 B.化学反应会引起化学键的变化
C.化学反应必然伴随着能量的变化 D.化学反应会产生新的物质
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三上学期期中考试化学试卷(解析版) 题型:选择题
氯化钠是一种重要的生活、生产必需品。下列表述中正确的是
A.NaCl的电子式为
B.NaCl的水溶液是强电解质
C.23Na37Cl中质子数和中子数之比是8:7
D.电解熔融氯化钠可得到氯气和金属钠
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.用氢氧化钠溶液除去铝表面的氧化膜:Al(OH)3+OH—=AlO2—+2H2O
B.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl— Mn2++Cl2↑+H2O
Mn2++Cl2↑+H2O
C.用惰性电极电解熔融氯化钠:2Cl—+2H2O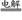 Cl2↑+H2↑+2OH—
Cl2↑+H2↑+2OH—
D.用稀氢氧化钠吸收氯气:2OH—+Cl2=Cl—+ClO—+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com