
科目: 来源:2011-2012学年江苏省高三下学期质量检测(三)化学试卷(解析版) 题型:选择题
下列离子方程式与所述事实不相符的是( )
A.苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-
B.在碳酸氢钠溶液中加入过量的氢氧化钡溶液:Ba2++OH-+HCO3-== BaCO3↓+H2O
C.用新制的氢氧化铜悬浊液检验乙醛中的醛基:
CH3CHO + 2Cu(OH)2 + OH- CH3COO-+ Cu2O↓ + 3H2O
CH3COO-+ Cu2O↓ + 3H2O
D.向Ca(ClO)2溶液中通入过量SO2:Ca2++ 2ClO— +SO2+H2O=CaSO4↓+2H++ Cl—+ HClO
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三下学期质量检测(三)化学试卷(解析版) 题型:选择题
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色。五种元素核电荷数之和为54,最外层电子数之和为20。W、Z最外层电子数相同,Z的核电荷数是W的2倍。工业上一般通过电解氧化物的方法获得Y的单质。则下列说法不正确的是( )
A.原子半径:X>Y>Q>W
B.Q和Z所形成的分子空间构型为直线形
C.Q和W可形成原子个数比为1:1和2:1的化合物
D.X、Y和W三种元素形成的化合物的水溶液呈碱性
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三下学期质量检测(三)化学试卷(解析版) 题型:选择题
BHT(Butylated Hydroxy Toluene)是一种常用的食品抗氧化剂,合成方法有如下两种:
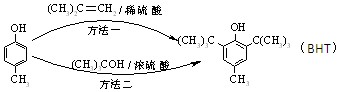
下列说法正确的是( )
A.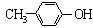 能与Na2CO3溶液反应生成CO2
能与Na2CO3溶液反应生成CO2
B. 与BHT互为同系物
与BHT互为同系物
C.BHT久置于空气中会被氧化
D.两种方法的反应类型都是加成反应
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三下学期质量检测(三)化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.△H>0的反应,常温下一定不能自发进行
B.用0.1mol/LNaOH溶液分别滴定相同物质的量浓度和相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线
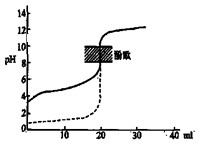
C.常温下,在0.1mol/L氨水中,加入少量NH4Cl晶体,溶液的pH减小
D.恒容密闭容器中进行的反应3A(g) 2B(g)+C(s),在其它条件不变的情况下,再充入一定量的A气体,A的转化率不变
2B(g)+C(s),在其它条件不变的情况下,再充入一定量的A气体,A的转化率不变
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三下学期质量检测(三)化学试卷(解析版) 题型:选择题
一定温度下的难溶电解质AmBn在水溶液中达到溶解平衡时。已知下表数据
|
物质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
|
Ksp/25℃ |
8.0×10-16 |
2.2×10-20 |
4.0×10-38[来源:ZXXK] |
|
完全沉淀时的pH范围 |
≥9.6 |
≥6.4 |
3~4 |
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不科学的是( )
A.向该溶液中加少量铁粉即能观察到红色固体析出
B.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
C.该溶液中c(SO42-):{c(Cu2+)+c(Fe2+)+c(Fe3+)}>5:4
D.向该溶液中加入适量氯水,并调节pH值到3~4后过滤,得到纯净的CuSO4溶液
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三下学期质量检测(三)化学试卷(解析版) 题型:选择题
25℃,a L 0.1000mol/L CH3COOH溶液与b L 0.1000 mol/L NaOH溶液混合,下列说法正确的是( )
A.若a>b,则pH一定小于7
B.若a<b,则一定存在:n(OH-)-n(H+)>0.1(b-a)
C.c(Na+)>c(CH3COO-)>c(OH-)>c(H+),则a≤b
D.若pH=7,则a>b,且c(Na+)=c(CH3COO-)+c(CH3COOH)
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三下学期质量检测(三)化学试卷(解析版) 题型:选择题
在三个2L恒容的容器中,分别发生反应A(g)+3B(g) 2C(g),5min后各容器反应达平衡状态,其中甲容器中A的物质的量为0.4mol。
2C(g),5min后各容器反应达平衡状态,其中甲容器中A的物质的量为0.4mol。
|
|
反应前各物质的物质的量/mol |
||
|
A |
B |
C |
|
|
甲 |
1 |
3 |
0 |
|
乙 |
0 |
0 |
2 |
|
丙 |
1.5 |
4.5 |
1 |
下列说法正确的是( )
A.乙中5min内C的反应速率为0.12mol/(L·min)
B.达到平衡时,丙中A的浓度是甲中的2倍
C.丙中反应的平衡常数大于甲中反应的平衡常数
D. 达到平衡时,甲乙两容器中C的物质的量百分含量相等
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三下学期质量检测(三)化学试卷(解析版) 题型:填空题
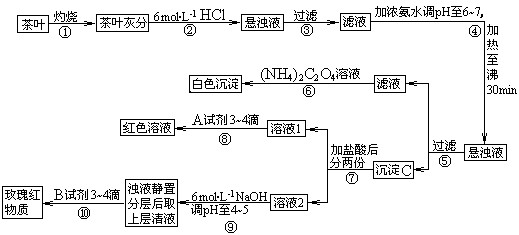
(14分)茶是我国人民喜爱的饮品。某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有钙、铁、铝三种金属元素。
[查阅部分资料]:草酸铵[(NH4)2C2O4]属于弱电解质;草酸钙(CaC2O4)难溶于水;Ca2+、A13+、Fe3+完全沉淀的pH:Ca(OH)2:pH≥13;A1(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1。
试根据上述过程及信息填空:
(1)步骤②加盐酸的作用是 _________________________________________ ;
(2)写出检验Ca2+的离子方程式 ___________________________;
(3)写出沉淀C所含主要物质的化学式 _____________________________;
(4)写出步骤⑧用A试剂生成红色溶液的离子方程式_____________________________;
(5)步骤⑨的作用是 ;
(6)猜测步骤⑩的目的是 _________________________________ ;
(7)已知:2Fe (s)+ 3/2O2 (g)= Fe2O3(s),△H = — Q1 kJ·mol-1
2Al(s) + 3/2O2 (g)= Al 2O3(s),△H = — Q2 kJ·mol-1
则Q1 ___________Q2 (填“>”, “<”或“=”)
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三下学期质量检测(三)化学试卷(解析版) 题型:填空题
(16分)止咳酮(F)具有止咳、祛痰作用。其生产合成路线如下:
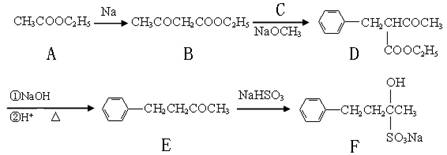
(1)写出B中含有的官能团名称: 。
(2)已知B→D反应属于取代反应,写出C(C属于氯代烃)的结构简式: 。
(3)写出E→F的反应类型: 。
(4)满足下列条件的E的同分异构体有 种。
①苯环上有两个邻位取代基; ②能与FeCl3溶液发生显色反应;
③除苯环外不含其它的环状结构。
(5)写出A→B的反应方程式: 。
(6)A→F六种物质中含有手性碳原子的是: (填物质代号)。
(7)目前我国用粮食发酵生产丙酮(CH3COCH3)占较大比重。利用题给相关信息,以淀粉为原料,合成丙酮。合成过程中无机试剂任选。
提示:合成路线流程图示例如下:
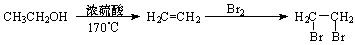
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三下学期质量检测(三)化学试卷(解析版) 题型:填空题
(15分)随着氮氧化物污染的日趋严重,国家将于“十二五”期间加大对氮氧化物排放的控制力度。目前,消除氮氧化物污染有多种方法。
(1)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2(g)+CO2 (g) △H。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2 (g) △H。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
|
浓度/mol·L-1 时间/min |
NO |
N2 |
CO2 |
|
0 |
0.100 |
0 |
0 |
|
10 |
0.058 |
0.021 |
0.021 |
|
20 |
0.040 |
0.030 |
0.030 |
|
30 |
0.040 |
0.030 |
0.030 |
|
40 |
0.032 |
0.034 |
0.017 |
|
50 |
0.032 |
0.034 |
0.017 |
①T1℃时,该反应的平衡常数K= (保留两位小数)。
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H 0(填“>”、“ =”或“<”)。
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
③H2O(g)=H2O(l) △H=-44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式 。
(3)以NO2、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨I电极反应生成一种氧化物Y,有关电极反应可表示为 。
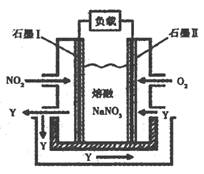
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com