
科目: 来源:2011-2012年黑龙江龙东地区高二下学期期末考试化学试卷(解析版) 题型:选择题
以下有关原子结构及元素周期律的叙述正确的是
A.第IA族元素铯的两种同位素137Cs比133Cs多4个质子
B.同周期元素(除零族元素外)从左到右,原子半径逐渐减小
C.第 ⅦA元素从上到下,其氢化物的稳定性逐渐增强
D.同主族元素从上到下,单质的熔点逐渐降低
查看答案和解析>>
科目: 来源:2011-2012年黑龙江龙东地区高二下学期期末考试化学试卷(解析版) 题型:选择题
在短周期中的X和Y两种元素可组成化合物XY3,则下列说法正确的是
A.若X的原子序数为m, 则Y的原子序数必定为m + 4
B.XY3晶体一定属于离子晶体
C.X和Y可属于两个不同周期,也可属于同一周期
D.X的原子半径小于Y的原子半径
查看答案和解析>>
科目: 来源:2011-2012年黑龙江龙东地区高二下学期期末考试化学试卷(解析版) 题型:选择题
下列化合物中含有手性碳原子的是
A.CCl2F2
B. CH2OHCHOHCH2OH
C.CH3CH2OH
D.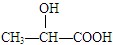
查看答案和解析>>
科目: 来源:2011-2012年黑龙江龙东地区高二下学期期末考试化学试卷(解析版) 题型:选择题
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高,硬度大,是一种重要的半导体材料。下列说法中,正确的是
A.X、M两种元素只能形成X2M型化合物
B.由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低
C.元素Y、Z、W的单质晶体属于同种类型的晶体
D.元素W和M的某些单质可作为水处理中的消毒剂
查看答案和解析>>
科目: 来源:2011-2012年黑龙江龙东地区高二下学期期末考试化学试卷(解析版) 题型:填空题
W、X、Y、Z是短周期元素,它们的核电荷数依次增大。下表列出它们的性质和结构:
|
元素编号 |
元素性质或原子结构 |
|
W |
原子电子层数与核外电子数相等 |
|
X |
核外S能级上的电子总数与P能级上的电子总数相等 |
|
Y |
元素的原子半径在该周期中最大(除稀有气体外) |
|
Z |
原子核外P能级上的电子总数比S能级上的电子总数多2 |
⑴元素符号:X_________ , Z________。
⑵Y元素原子的核外最外层电子排布式为____________。
⑶W和X形成的化合物的电子式________________,该化合物为________分子(填“极性”或“非极性”)。Z和X形成的化合物构成的晶体属于__________晶体。
⑷Y元素的单质在W和X形成的化合物中反应的化学方程式为______________________________。
查看答案和解析>>
科目: 来源:2011-2012年黑龙江龙东地区高二下学期期末考试化学试卷(解析版) 题型:填空题
研究物质的微观结构,有助于人们理解物质变化的本质。请回答:
(1)C、Si、N元素的电负性由大到小的顺序是 ,C60和金刚石都是碳的同素异形体,金刚石熔点高于C60的熔点,原因是 ;
(2) A、B均为短周期金属元素。依据下表数据,写出B原子的电子排布式 ;
|
电离能/kJ•mol-1 |
I1 |
I2 |
I3 |
I4 |
|
A |
932 |
1821 |
15390 |
21771 |
|
B |
738 |
1451 |
7733 |
10540 |
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+ 颜色(填“无”或“有”);
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
① COCl2分子的结构式为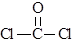 ,COCl2分子内含有
(填标号);
,COCl2分子内含有
(填标号);
A.4个σ键 B.2个σ键、2个π键 C.2个σ键、1个π键 D.3 个σ键、1个π键
② Fe(CO)5在一定条件下发生分解反应:Fe(CO)5=Fe(s)+5CO,反应过程中,断裂的化学键只有配位键,形成的化学键是 。
查看答案和解析>>
科目: 来源:2011-2012年黑龙江龙东地区高二下学期期末考试化学试卷(解析版) 题型:填空题
镍(Ni)可形成多种配合物,且各种配合物均有广泛的用途。
(1)配合物Ni(CO)4常温下呈液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于________晶体;写出两种与配体CO互为等电子体的粒子的化学式________、________。
(2)某镍配合物结构如下图所示,分子内含有的作用力有________(填序号)。

A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应,如
①  ②
②  、③
、③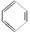 、④ HCHO等,其中碳原子采取sp2杂化的分子有________(填序号);HCHO分子的空间构型为________ 。
、④ HCHO等,其中碳原子采取sp2杂化的分子有________(填序号);HCHO分子的空间构型为________ 。
(4)据报道,含有镁、镍和碳三种元素的某种晶体具有超导性,其结构如下图所示。则该晶体的化学式为________。晶体中每个镁原子周围距离最近的镍原子有________个。
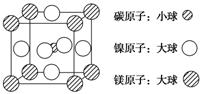
查看答案和解析>>
科目: 来源:2011-2012年黑龙江龙东地区高二下学期期末考试化学试卷(解析版) 题型:填空题
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
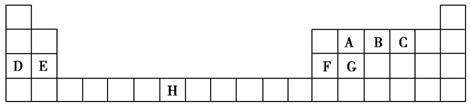
试回答下列问题:
(1)B、D、F、G的第一电离能由小到大的顺序为______(用元素符号表示)。
(2)请写出元素H的基态原子电子排布式_____________________。
(3)A的最简单氢化物分子里中心原子采取________形式杂化,A的最高价氧化物分子的空间构型是________。
(4)D的氯化物的熔点比G的氯化物的熔点________(填“高”或“低”),理由是__________________________。
(5)元素C与元素G形成的晶体所属的晶体类型为________晶体,在该晶体中原子间形成的共价键属于________(从下列选项中选出正确类型)。
A.σ键 B.π键 C.既有σ键,又有π键
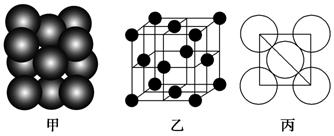
(6)F单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。晶胞中F原子的配位数为________,一个晶胞中F原子的数目为________。
查看答案和解析>>
科目: 来源:2011学年浙江省瑞安十校高一第二学期期中联考化学试卷(解析版) 题型:选择题
“可燃冰”又称“天然气水合物”,它是在海底的高压、低温条件下形成的,外观象冰。1体积“可燃冰”可储藏100~200体积的天然气。下面关于“可燃冰”的叙述不正确的是
A.“可燃冰”有可能成为人类未来的重要能源
B.“可燃冰”是一种比较洁净的能源
C.“可燃冰”提供了水可能变成油的例证
D.“可燃冰”的主要可燃成分是甲烷
查看答案和解析>>
科目: 来源:2011学年浙江省瑞安十校高一第二学期期中联考化学试卷(解析版) 题型:选择题
我国科学家最近发现一种只有六个中子构成的粒子,这种粒子称为“六中子”,也有人称之为“零号元素”。下列有关“六中子”粒子的说法不正确的是
A.该粒子不显电性 B.该粒子质量数为6
C.在周期表中与氢元素占同一位置 D.该粒子质量比氢原子的大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com