
科目: 来源:2013届福建省高二下学期期中考试化学试卷(解析版) 题型:选择题
、化学反应C(s)+H2O(g) CO(g)+H2(g);△H>0达到平衡,下列叙述正确的是
CO(g)+H2(g);△H>0达到平衡,下列叙述正确的是
A.升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.加入固体碳,平衡向正反应方向移动
C.减小压强,平衡向正反应方向移动
D.加入水蒸气使容器压强增大,平衡向逆反应方向移动
查看答案和解析>>
科目: 来源:2013届福建省高二下学期期中考试化学试卷(解析版) 题型:选择题
COCl2(g)
 CO(g)+Cl2(g) △H>0,当反应达到平衡时,下列措施 ①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂
⑥恒压时通入惰性气体,能提高COCl2转化率的是( )
CO(g)+Cl2(g) △H>0,当反应达到平衡时,下列措施 ①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂
⑥恒压时通入惰性气体,能提高COCl2转化率的是( )
A.①②④ B.①④⑥ C.②③⑥ D.③⑤⑥
查看答案和解析>>
科目: 来源:2013届福建省高二下学期期中考试化学试卷(解析版) 题型:选择题
图1为某化学反应的速率与时间的关系示意图。下列有关t1时刻改变条件的说法正确的是( )
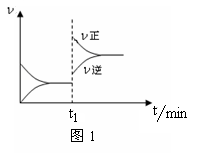
A.2SO2(g)+O2(g)
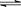 2SO3(g) ΔH<0,t1时刻升高温度
2SO3(g) ΔH<0,t1时刻升高温度
B.4NH3(g)+5O2(g)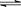 4NO(g)+6H2O(g) ΔH<0,t1时刻增大O2浓度
4NO(g)+6H2O(g) ΔH<0,t1时刻增大O2浓度
C.H2O(g)+CO(g) 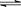 H2(g)+CO2(g) ΔH>0, t1时刻增大压强
H2(g)+CO2(g) ΔH>0, t1时刻增大压强
D.C(s)+H2O(g) 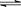 CO(g)+H2(g) ΔH>0,t1时刻升高温度
CO(g)+H2(g) ΔH>0,t1时刻升高温度
查看答案和解析>>
科目: 来源:2013届福建省高二下学期期中考试化学试卷(解析版) 题型:选择题
在一密闭容器中,反应aA(g)  bB(g),达到平衡后,保持温度不变,将容器体积增加1倍,当达到新的平衡时,B的浓度是原来的70%,则
bB(g),达到平衡后,保持温度不变,将容器体积增加1倍,当达到新的平衡时,B的浓度是原来的70%,则
A.平衡向逆反应方向移动了 B.物质A的转化率减小了
C.物质B的质量分数增加了 D.化学计量数关系:a>b
查看答案和解析>>
科目: 来源:2013届福建省高二下学期期中考试化学试卷(解析版) 题型:选择题
在一密闭容器中有如下反应:L (s) + a G (g)  b R (g) 温度和压强对该反应的影响如图所示,其中压强P1 < P2,由此可判断
b R (g) 温度和压强对该反应的影响如图所示,其中压强P1 < P2,由此可判断
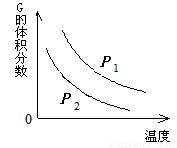
A. 正反应为放热反应
B. 化学方程式中的计量数a > b
C. G的转化率随温度升高而减小
D. 增大压强,容器内气体质量不变
查看答案和解析>>
科目: 来源:2013届福建省高二下学期期中考试化学试卷(解析版) 题型:选择题
在一定条件下,恒容的密闭容器中发生如下反应:2SO2 (g)+O2(g)  2SO3(g),反应过程中某一时刻测得SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当反应达到平衡时,可能出现的数据是( )
2SO3(g),反应过程中某一时刻测得SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当反应达到平衡时,可能出现的数据是( )
A.C(SO3)=0.4mol·L-1 B.C(SO3)+C(SO2)=0.15 mol·L-1
C.C(O2)=0.3mol·L-1 D.C(SO3)+C(SO2)=0.4 mol·L-1
查看答案和解析>>
科目: 来源:2013届福建省高二下学期期中考试化学试卷(解析版) 题型:选择题
下图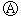 为直流电源,
为直流电源,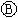 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,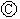 为电镀槽.接通电路后(此时开关处于打开状态)发现
为电镀槽.接通电路后(此时开关处于打开状态)发现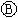 上的c点显红色。接通
上的c点显红色。接通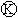 使c、d两点短路后,可以实现铁上镀锌。下列叙述正确的是
使c、d两点短路后,可以实现铁上镀锌。下列叙述正确的是
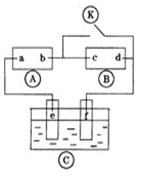
A. a为直流电源的负极 B. c极发生的反应为2H++2e-=H2↑
C. f电极为锌板 D. e极发生还原反应
查看答案和解析>>
科目: 来源:2013届福建省高二下学期期中考试化学试卷(解析版) 题型:填空题
(9分)(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g) + 3H2O(1)  2NH3(g) +
2NH3(g) + 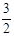 O2(g)
;△H = a kJ·mol—1
O2(g)
;△H = a kJ·mol—1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
|
T/K |
303 |
313 |
323 |
|
NH3生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
①此合成反应的a 0;ΔS 0,(填“>”、“<”或“=”)
②已知:N2(g) + 3H2(g) 2NH3(g) ΔH= -92.4kJ·mol—1
2NH3(g) ΔH= -92.4kJ·mol—1
2H2(g) + O2(g) 2H2O(l)
ΔH = -571.6kJ·mol—1
2H2O(l)
ΔH = -571.6kJ·mol—1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为:
(2)①已知:0.5mol液态肼(N2H4)与足量的液态双氧水反应生成氮气和水蒸气,放出256kJ的热量,写出该反应的热化学方程式
②又已知H2O(g)=H2O(l) △H=-44kJ•mol-1。则32g液态肼与足量的液态双氧水反应生成氮气和液态水时放出的热量是 kJ
③此反应用于火箭推进,除释放大量热和快速产生大量气体外还有一个很大优点是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com