
科目: 来源:2013届福建省高二下学期第一次月考化学试卷(解析版) 题型:选择题
当两个氢原子核间距为74pm时,两个原子轨道发生最大程度的重叠,此时体系的能量最低。下图表示两个气态基态氢原子相互接近形成氢气分子时,体系能量随两个原子的核间距离变化的曲线图,下列关于氢原子形成氢分子说法不正确的有
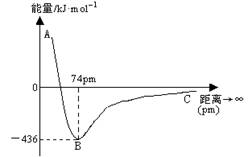
A.氢分子比氢原子稳定
B.氢原子的半径约为37pm
C.形成一个H—H键吸收436kJ能量
D.当核间距接近74pm时,形成了氢分子中s~s σ键
查看答案和解析>>
科目: 来源:2013届福建省高二下学期第一次月考化学试卷(解析版) 题型:选择题
某基态原子第四电子层只有1个电子,该原子的第三电子层电子数可能有
A.13 B.16 C.8~18 D.18~32
查看答案和解析>>
科目: 来源:2013届福建省高二下学期第一次月考化学试卷(解析版) 题型:选择题
下列有关σ键和π键的说法错误的是
A.在某些分子中,化学键可能只有π键而没有σ键
B.当原子形成分子时,首先形成σ键,可能形成π键
C.一般情况下,同一个分子中的σ键比π键更稳定些
D.含有π键的分子在反应时,π键是化学反应的积极参与者
查看答案和解析>>
科目: 来源:2013届福建省高二下学期第一次月考化学试卷(解析版) 题型:选择题
三氯化氮(NCl3)是一种淡黄色的油状液体,测得其分子具有三角锥形结构,则下面对于NCl3的描述不正确的是
A.N原子是sp3杂化 B.该分子中的氮原子上有孤对电子
C.它还可以再以配位键与Cl-结合 D.已知NBr3对光敏感,所以NCl3对光也敏感
查看答案和解析>>
科目: 来源:2013届福建省高二下学期第一次月考化学试卷(解析版) 题型:选择题
A原子的结构示意图为 。则X、Y及该原子3p能级上的电子数分别可能为
。则X、Y及该原子3p能级上的电子数分别可能为
A.18、6、4 B.24、12、6 C.18、8、6 D.26、14、6
查看答案和解析>>
科目: 来源:2013届福建省高二下学期第一次月考化学试卷(解析版) 题型:填空题
(8分)研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题。
(1)C、Si、N元素的电负性由大到小的顺序是__________________。
(2)A、B均为短周期金属元素。依据下表数据,写出B原子的电子排布式:______________。
|
电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4[来源:ZXXK] |
|
A |
932 |
1 821 |
15 390 |
21 771 |
|
B |
738 |
1 451 |
7 733 |
10 540 |
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,过渡金属离子为d0或d10排布时,无颜色,d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+________颜色(填“无”或“有”)。
(4)利用CO可以合成化工原料COCl2。请判断COCl2分子内含有________。
A.4个σ键 B.2个σ键、2个π键 C.2个σ键、1个π键 D.3个σ键、1个π键
查看答案和解析>>
科目: 来源:2013届福建省高二下学期第一次月考化学试卷(解析版) 题型:填空题
(5分)决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
|
电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
|
A |
578 |
1817 |
2745 |
11578 |
|
B |
738 |
1451 |
7733 |
10540 |
A通常显________价,A的电负性_____B的电负性(填“>”、“<”或“=”)。
(2)已知:波长为300nm的紫外光的光子所具有的能量约为399 kJ/mol。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:______________________
|
共价键 |
C-C |
C-N |
C-S |
|
键能/ kJ·mol-1 |
347 |
305 |
259 |
(3)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是__________________。
查看答案和解析>>
科目: 来源:2013届福建省高二下学期第一次月考化学试卷(解析版) 题型:填空题
(15分)下表为元素周期表的一部分,请参照元素A-K在表中的位置,
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
A |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
B |
C |
D |
|
|
|
3 |
E |
|
F |
G |
|
|
K |
|
请回答下列问题:
(1)D、E、F的原子半径由大到小的顺序为_________________________。(用元素符号表示)
(2)B、C、D的第一电离能由大到小的顺序为_________________________。(用元素符号表示)
(3 E、F的最高价氧化物的水化物相互反应的离子方程式_____________________
(4)在B所形成的化合物HCHO、CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有____________;(写结构式,两种)
(5)由A、B、C、D、E元素中某几种组成的10电子微粒子中,含配位键的分子或离子有_________、_________;(写化学式)
(6)由F和K两种元素组成的化合物中,其化学键类型为______________。(填“共价键”或“离子键”),该化合物的二聚体的分子式为Al2Cl6,其结构式为下列四种中的一种,你认为正确的结构是______________。

查看答案和解析>>
科目: 来源:2013届福建省高二下学期第一次月考化学试卷(解析版) 题型:填空题
(5分)在元素周期表中,元素的金属性和非金属性及其强弱比较与周期数(n)和主族数(A)有如下经验公式:K=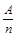 (K为A与n的比值)。请用编号回答下列问题:
(K为A与n的比值)。请用编号回答下列问题:
A.两性 B.金属 C.非金属 D.稀有气体
(1)当n一定时,K值越大,则元素的_____性越强
(2)当A一定时,K值越小,则元素的_____性越强
(3)当K=0,则该元素系_____元素,当K=l时(n≠1),则该元素系_____元素,当K<1时,该元素系____元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com