
科目: 来源:2013届湖北武汉部分重点学校高二下学期期末统考化学卷(解析版) 题型:填空题
(10分)下表为长式周期表的一部分,其中的编号代表对应的元素。

⑴表中属于ds区的元素是 (填编号)。
⑵元素②与③形成的一种化合物是重要的化工原料,该化合物可用于人工降雨。有关该化合物分子的说法正确的是 。
A.分子中含极性共价键
B.含有1个σ键和2个π键
C.属于非极性分子
D.该化合物分子中,②原子采用sp2杂化
⑶根据上述表格中的十种元素填空:
I、金属性最强的主族元素的电子排布式为_____________;
II、⑤、⑥、⑦的离子半径由小到大的顺序是___________ (填化学式)
III、⑥、⑦两种元素的最高价氧化物对应的水化物的酸性由大到小的顺序是_____ _ (填化学式), *
⑷某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为 ___;该元素与元素①形成的分子X的空间构型为 。
查看答案和解析>>
科目: 来源:2013届湖北武汉部分重点学校高二下学期期末统考化学卷(解析版) 题型:填空题
(12分)按要求回答下列问题
(1)用标准NaOH溶液滴定未知浓度的盐酸,用酚酞作指示剂,下列操作中会导致实验结果偏低的是 (填序号 )
①碱式滴定管用蒸馏水洗净后没有用标准液润洗
②锥形瓶用蒸馏水洗净后没有用待测液润洗
③用酸式滴定管加待测液时,刚用蒸馏水洗净后的滴定管未用待测液润洗
④滴定前滴定管尖端有气泡,滴定后气泡消失
⑤终点读数时俯视,其他读数方法正确
(2)某课外活动小组同学用右图甲装置进行实验,试答下列问题:
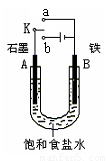
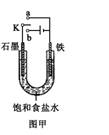 ①若开始时开关K与a连接,则铁发生电化学腐蚀中的
腐蚀。
①若开始时开关K与a连接,则铁发生电化学腐蚀中的
腐蚀。
②若开始时开关K与b连接,则总反应的离子方程式为 。
(3)常温下,如果取0.1mol/L HA溶液与0.1mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,求出混合液中下列算式的精确计算结果(填具体数字):c(OH-)-c(HA)= ___________ mol/L。
(4)在Cl-、Al3+、HSO4-、K+、HS-五种离子中,只能水解不能电离的离子是 ,只能电离不能水解的离子是 ,既能电离又能水解的离子是 ,写出能水解离子的水解离子方程式 , 。
(5)已知25℃时,Mg(OH)2的溶度积常数Ksp = 5.6×10-12,测得某溶液的pH = 13,则此温度下溶液中的c(Mg2+) = ____________________。
查看答案和解析>>
科目: 来源:2013届湖北武汉部分重点学校高二下学期期末统考化学卷(解析版) 题型:填空题
(12分)现在普遍应用的工业合成氨的方法是哈伯于1905年发明的,但此法反应物的转化率不高。
(1)已知1 mol N2(g)与适量H2(g)完全反应,当生成NH3(g)0.1mol时,放出9.22kJ热量,写出反应的热化学方程式: 。
(2)若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1 K2(填“>” “=” 或 “<” )。
(3)在一定温度下,向容积不变(始终为10L)的密闭容器中加入2 mol N2、8 mol H2 及固体催化剂。10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,此时氨气的体积分数为 ,用氮气表示的反应速率: 。若想提高氨气的产率,根据化学平衡移动原理,请提出合理的建议: (任意写一条)。
(4)在上述相同条件下,若起始时加入4 mol NH3、2 mol H2及固体催化剂,反应达到平衡时NH3的体积分数比(3)中 (填“大”、“小”或“相等”)。
(5)随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如右图)。在电解法合成氨的电解池中 (填“能”或“不能”) 用水作电解质溶液的溶剂,原因是 。
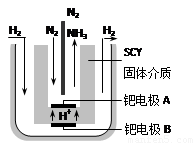
钯电极A是电解池的 极(填“阳”或“阴”),该极上的电极反应式是 。
查看答案和解析>>
科目: 来源:2013届湖北武汉部分重点学校高二下学期期末统考化学卷(解析版) 题型:填空题
(11分)研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
(1)O、Si、N元素的电负性由大到小的顺序是_______________。
C60和金刚石都是碳的同素异形体,二者比较熔点高的是_______,原因是________________。
(2)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
①COCl2分子的结构式为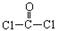 每个COCl2分子内含有
个δ键, 个π键。其中心原子采取 杂化轨道方式。
每个COCl2分子内含有
个δ键, 个π键。其中心原子采取 杂化轨道方式。
②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g)反应过程中,断裂的化学键只有配位键,则形成的化学键类型是_______________。
(3)CaTiO3晶体中(晶胞结构如图所示) ,Ti4+的氧配位数为________;晶体中,若将Ti4+置于立方体的体心,Ca2+置于立方体的顶点,则O2-处于立方体的______;
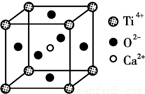
查看答案和解析>>
科目: 来源:2013届湖北省武汉市四校高二上学期期中考试化学试卷(解析版) 题型:选择题
近年来,有科学家提出硅是“21世纪的能源”“未来的石油”的观点。下列关于硅的说法中不正确的是
A.硅是一种亲氧元素,在自然界中它总是与氧相互化合的。
B.硅的来源丰富,易于开发,且可再生
C.硅燃烧放出的热量大,且燃烧产物对环境污染较低,容易有效控制
D.寻找高效催化剂,使二氧化硅分解产生硅的同时释放能量,是硅能源大规模开发利用的一项关键技术
查看答案和解析>>
科目: 来源:2013届湖北省武汉市四校高二上学期期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A. 化学反应除了生成新的物质外,还伴随着能量的变化
B. 据能量守恒定律,反应物的总能量一定等于生成物的总能量
C. 放热的化学反应不需要加热就能发生
D. 吸热反应不加热就不会发生
查看答案和解析>>
科目: 来源:2013届湖北省武汉市四校高二上学期期中考试化学试卷(解析版) 题型:选择题
相同温度下,两种氨水A、B,浓度分别是0.2 mol/L和0.1 mol/L,则A和B的OH-浓度之比
A.大于2 B.小于2 C.等于2 D.不能确定
查看答案和解析>>
科目: 来源:2013届湖北省武汉市四校高二上学期期中考试化学试卷(解析版) 题型:选择题
pH相同的醋酸和盐酸,分别用蒸馏水稀释至原来体积的m倍和n倍。稀释后的溶液的pH仍相等,则m和n的关系是
A.m>n B.m=n C.m<n D.不能确定
查看答案和解析>>
科目: 来源:2013届湖北省武汉市四校高二上学期期中考试化学试卷(解析版) 题型:选择题
强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(1) ⊿H=-57.3kJ/mol。向1L0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时的热效应⊿H1、⊿H2、⊿H3的关系正确的是
A.⊿H1>⊿H2>⊿H3 B.⊿H1<⊿H3<⊿H2
C.⊿H1<⊿H2<⊿H3 D.⊿H1>⊿H3>⊿H2
查看答案和解析>>
科目: 来源:2013届湖北省武汉市四校高二上学期期中考试化学试卷(解析版) 题型:选择题
反应2A(g)? ?2B(g)+C(g) ⊿H>
0,达到平衡时,要使逆反应速率降低,A的浓度增大,应采取的措施是
?2B(g)+C(g) ⊿H>
0,达到平衡时,要使逆反应速率降低,A的浓度增大,应采取的措施是
A.减压 B.降温 C.加压 D.增大B的浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com