
科目: 来源:2013届海南省高二上学期期末考试理科化学试卷(解析版) 题型:选择题
25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) 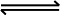 Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )

A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0
D.25 ℃时,该反应的平衡常数K=2.2
查看答案和解析>>
科目: 来源:2013届海南省高二上学期期末考试理科化学试卷(解析版) 题型:选择题
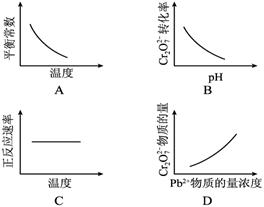
电镀废液中Cr2O72—可通过下列反应转化成铬黄(PbCrO4):
Cr2O72—(aq)+2Pb2+(aq)+H2O(l)  2PbCrO4(s)+2H+(aq) ΔH< 0
2PbCrO4(s)+2H+(aq) ΔH< 0
该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是( )
查看答案和解析>>
科目: 来源:2013届海南省高二上学期期末考试理科化学试卷(解析版) 题型:选择题
将浓度为0.1 mol·L-1HF溶液加水不断稀释,下列各量始终保持增大的是( )
A. c(H+)
B. K(HF) C. D.
D. 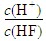
查看答案和解析>>
科目: 来源:2013届海南省高二上学期期末考试理科化学试卷(解析版) 题型:选择题
将5.6g铁粉投入100mL2mol/L的稀硫酸中,2min时铁刚好完全溶解(忽略溶液体积变化)。下列有关这个反应的反应速率表示正确的是( )
A.铁的反应速率为0.5mol/(L·min) B.硫酸 的反应速率为0.5mol/(L·min)
C.硫酸亚铁的反应速率为0.5mol/(L·min)D. 氢气的反应速率为0.5mol/(L·min)
查看答案和解析>>
科目: 来源:2013届海南省高二上学期期末考试理科化学试卷(解析版) 题型:选择题
在25℃时,取PH均等于2的盐酸和醋酸溶液各100ml,先分别加水稀释至2 倍体积,再分别加入过量的锌粉。下列说法正确的是( )
A.醋酸与锌反应放出氢气多 B. 两种酸放出氢气一样多
C.醋酸与锌反应速率大 D.两种酸与锌反应的速率一样大
查看答案和解析>>
科目: 来源:2013届海南省高二上学期期末考试理科化学试卷(解析版) 题型:选择题
已知在等温等容条件下,有如下可逆反应:2A(g) +
2B(g)  3C(g) + D(g),现分别从两条途径建立平衡,途径Ⅰ:A、B的初始浓度均为2
mol/L;途径Ⅱ:C、D的初始浓度分别为6 mol/L和2 mol/L.下列叙述正确的是(
)
3C(g) + D(g),现分别从两条途径建立平衡,途径Ⅰ:A、B的初始浓度均为2
mol/L;途径Ⅱ:C、D的初始浓度分别为6 mol/L和2 mol/L.下列叙述正确的是(
)
A.Ⅰ、Ⅱ途径分别达到平衡时,两体系内相同气体的浓度相等
B. Ⅰ、Ⅱ途径分别达到平衡时,两体系内相同气体的体积分数相等
C. Ⅰ、Ⅱ途径分别达到平衡时,两体系内相同气体的反应速率相等
D. Ⅰ、Ⅱ途径分别达到平衡时,Ⅱ的气体密度是Ⅰ的两倍
查看答案和解析>>
科目: 来源:2013届海南省高二上学期期末考试理科化学试卷(解析版) 题型:选择题
已知一定温度下2X(g) + Y (g)  mZ(g)
ΔH= -a kJ·mol-1 (a>0),现有甲乙两容积相等且固定不变的密闭容器,在保持该温度下,向密闭容器甲中通入2molX和1molY,达到平衡状态时,放出热量bkJ;向密闭容器乙中通入1molX和0.5molY,达到平衡状态时,放出热量ckJ,且b>2c,则a、b、m的值或关系正确的是( )[来源:Z§xx§k.Com]
mZ(g)
ΔH= -a kJ·mol-1 (a>0),现有甲乙两容积相等且固定不变的密闭容器,在保持该温度下,向密闭容器甲中通入2molX和1molY,达到平衡状态时,放出热量bkJ;向密闭容器乙中通入1molX和0.5molY,达到平衡状态时,放出热量ckJ,且b>2c,则a、b、m的值或关系正确的是( )[来源:Z§xx§k.Com]
A.m=4 B.a=b C.b<a D.m等于2或1
查看答案和解析>>
科目: 来源:2013届海南省高二上学期期末考试理科化学试卷(解析版) 题型:填空题
( 10分)下列物质:①NaCl固体②无水乙醇③稀硫酸④BaSO4固体⑤冰醋酸⑥H2⑦CO2⑧熔融的KOH(选序号填空)
(1)能导电:_____________(2)非电解质:_____________________
(3)强电解质:_____________(4)弱电解质:____________________
(5)已知25℃时两种酸的电离常数:
Ka(CH3COOH)=1.75×10-5, Ka(HClO)=3.0×10-8
判断该反应是否能发生,若能,完成反应方程式;若不能,无需。
CH3COOH + Ca(ClO)2 ——
查看答案和解析>>
科目: 来源:2013届海南省高二上学期期末考试理科化学试卷(解析版) 题型:填空题
(11分)(1)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知: CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=+247.4 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为______________________________;
(2)在体积不变的密闭容器中进行(1)反应,达到平衡后(填“正向移动”、“逆向移动”、“增大”、“减小”或“不变”):
①扩大容器体积,平衡___________,c(H2)____________(与原平衡相比);
②升高温度,正反应速率________ ,逆反应速率___________;
体系的压强__________,平衡___________,平衡常数_____________;
③加入催化剂,H2的物质的量___________________。
查看答案和解析>>
科目: 来源:2013届海南省高二上学期期末考试理科化学试卷(解析版) 题型:填空题
(11分)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2IO3-+5SO32- +2H+ = I2+5SO42-+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:[来源:学&科&网]
|
|
0.01mol·L-1KIO3酸性溶液(含淀粉)的体积/mL |
0.01mol·L-1 Na2SO3溶液的体积/mL |
H2O的体积/mL |
实验温度 /℃ |
溶液出现蓝色时所需时间/s |
|
实验1 |
5 |
V1 |
35 |
25 |
t 1 |
|
实验2 |
5 |
5 |
40 |
25 |
t 2 |
|
实验3 |
5 |
5 |
V2 |
0 |
t 3[来源:] |
(1) 碘酸钾与亚硫酸钠的反应是 ___________________(填反应类型);
(2)该实验的目的是①____________________________________________,
②_____________________________________________________________;
(3)表中V2=___________mL, V1=___________mL
(4)t1_______ t2_________t3(填“<”、“>”或“=”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com