
科目: 来源:2014届四川省高一下半期考试化学试卷(解析版) 题型:选择题
在一恒容密闭容器中注入NO2,在25℃时建立下列平衡:2NO2(g)  N2O4(g) (正反应放热),若把容器置于100℃的沸水中,下列情况:①颜色、②气体平均相对分子质量、③质量、④压强、⑤密度中不变的是( )
N2O4(g) (正反应放热),若把容器置于100℃的沸水中,下列情况:①颜色、②气体平均相对分子质量、③质量、④压强、⑤密度中不变的是( )
A.③⑤ B.③④ C.②④ D.①③
查看答案和解析>>
科目: 来源:2014届四川省高一下半期考试化学试卷(解析版) 题型:选择题
在一定温度下,下列叙述不是可逆反应A(气)+3B(气)  2C(气)+2D(固)达到平衡的标志的是 (
)
2C(气)+2D(固)达到平衡的标志的是 (
)
①C的生成速率与C的分解速率相等
②单位时间内生成a mol A,同时生成3a mol B
③A、B、C的浓度不再变化
④A、B、C的分压强不再变化
⑤混合气体的总压强不再变化
⑥混合气体的物质的量不再变化
⑦A、B、C、D的分子数之比为1:3:2:2
A.②⑦ B.②⑤⑦ C.①③④ D.②⑤⑥⑦
查看答案和解析>>
科目: 来源:2014届四川省高一下半期考试化学试卷(解析版) 题型:选择题
FeS与足量的稀硝酸反应,生成Fe(NO3)3、S、NO和H2O。若反应中有0.3 mol的电子转移,则参加反应的硝酸中未被还原的硝酸的物质的量为( )
A.0.9 mol B.0.45 mol C.0.3 mol D.0.1 mol
查看答案和解析>>
科目: 来源:2014届四川省高一下半期考试化学试卷(解析版) 题型:填空题
(4分)在下列化合物中:① H2O,② Na2O,③ I2,④ NaCl,⑤ KOH,⑥ CO2,⑦ NH4Cl,⑧Na2O2,请填空(用序号表示):
(1)只由非金属组成的离子化合物是 ,
(2)含有极性共价键的离子化合物是 ,
(3)只含有非极性共价键的是 ,
(4)既有离子键又有非极性键的化合物是 。
查看答案和解析>>
科目: 来源:2014届四川省高一下半期考试化学试卷(解析版) 题型:填空题
(6分)某温度时,在5 L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题。

(1)反应开始至2 min,Y的平均反应速率为 ;
(2)分析有关数据,写出X、Y、Z的反应方程式:
;
(3)反应达到最大限度时,Y的转化率为 。
查看答案和解析>>
科目: 来源:2014届四川省高一下半期考试化学试卷(解析版) 题型:填空题
(9分)下图是中学教材中元素周期表的一部分,其中标出A~Q14种元素,试回答下列问题:
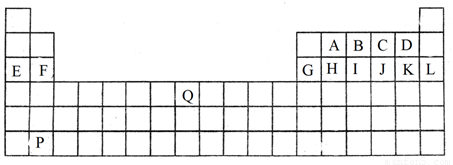
(1)在上表所列出的短周期元素中(填具体物质化学式)原子半径最小的是(除稀有气体元素) ;阴离子还原性最弱的是 ;
最高价氧化物对应的水化物中酸性最强的是 。
(2)F和G两元素相比较,金属性较强的是 (填名称),可以验证该结论的实验是 。(填编号)
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将这两种元素的单质粉末分别和同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
(3)Q在元素周期表中的位置是 ,B元素形成的单质的结构式为 。
(4)写出E的最高价氧化物对应的水化物与G单质发生的反应的离子方程式:
。
查看答案和解析>>
科目: 来源:2014届四川省高一下半期考试化学试卷(解析版) 题型:推断题
(9分)有A、B、C、D、E五种元素,A元素形成的-2价阴离子比氦的核外电子数多8个。B元素的一种氧化物为淡黄色固体,该固体遇到空气能生成A的单质。C为原子核内有12个中子的二价金属,当2.4 g C与足量盐酸反应时,生成标准状况下的H2 2.24 L。D的原子M层上有7个电子,E与A同周期且最外层比次外层多3个电子。
(1)C离子的结构示意图 。
(2)A、E氢化物的稳定性比较 。(填化学式)
(3)A、B、C、D四种离子半径由大到小顺序 (用离子符号表示)。
(4)用电子式表示C与D形成化合物的形成过程:
。
(5)写出D单质与B的最高价氧化物对应水化物反应的离子方程式:
。
(6)写出Cu与E的最高价氧化物对应水化物稀溶液反应的离子方程式:
。
查看答案和解析>>
科目: 来源:2014届四川省高一下半期考试化学试卷(解析版) 题型:填空题
(10分)有如下两个反应
A:2HCl+Ba(OH)2=BaCl2+2H2O B:2Fe3++Cu=2Fe2++Cu2+
(1)根据两反应的本质,判断能否设计成原电池:A ,B ,(填“能”或“不能”)不能设计成原电池的原因是 ;
(2)根据能设计成原电池的反应选择适合的材料和试剂设计一个原电池
①负极材料是 ,正极材料是 ,电解质溶液是 ;
②写出负极的电极反应式 ;
③若导线上转移电子0.2 mol,则负极质量减少 。
查看答案和解析>>
科目: 来源:2014届四川省高一下半期考试化学试卷(解析版) 题型:实验题
(14分)
Ⅰ.有甲、乙两位学生均想利用原电池反应检测金属的活动性顺序,两人均使用镁片和铝片作电极,但甲同学将电极放入2 mol/L H2SO4溶液中,乙同学将电极放入2 mol/L的NaOH溶液中,如图:

(1)写出甲池中正极的电极反应式: ;
(2)写出乙池中负极的电极反应式: ;
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出 活动性更强,而乙会判断出 活动性更强(填元素符号)。
(4)由此实验,可得到如下哪些正确结论?( )
A.利用原电池反应判断金属活动性顺序时应注意选择合适的电解质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动顺序表已过时,已设有实用价值
D.该实验说明化学研究对象复杂、化学反应受条件影响较大,因此应具体问题具体分析
Ⅱ.向一个容积为2 L的密闭容器中充入2 mol A和1
mol B,发生如下反应:2 A(g)
+ B(g)  xC(g) + D(g),反应达到平衡时C的浓度为1.2 mol/L,B的浓度为0.1 mol/L。
xC(g) + D(g),反应达到平衡时C的浓度为1.2 mol/L,B的浓度为0.1 mol/L。
(1)x= ;
(2)若使容器温度升高,平衡时混合气体的平均相对分子质量减小,则正反应为
(填“吸热”或“放热”)反应;
(3)若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是 (用序号填空)
①4 mol A + 2 mol B
②3 mol C + 1 mol D
③3 mol C + 1 mol D +1 mol B
查看答案和解析>>
科目: 来源:2014届四川省高一下学期期中考试化学试卷(解析版) 题型:选择题
对酸雨的pH描述中最准确是( )
A.小于7 B.小于5.6 C.在5.6~7之间 D.等于5.6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com