
科目: 来源:2013届四川省高二下学期期中考试化学试卷(解析版) 题型:选择题
有①Na2CO3溶液 ②CH3COONa溶液 ③NaOH溶液 ④CH3COONH4溶液各25 mL,物质的量浓度均为0.1 mol·L-1,下列说法正确的是
A.水电离的c(OH-)最大的是③
B.四种溶液pH大小顺序③>②>①>④
C.若将四种溶液稀释相同倍数,pH变化最大的是④
D.若分别加入25 mL 0.1 mol·L-1盐酸充分反应后,pH最大的是①
查看答案和解析>>
科目: 来源:2013届四川省高二下学期期中考试化学试卷(解析版) 题型:选择题
已知25℃时,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10。现向1 L 0.2 mol·L-1 HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中,正确的是
A.HF与CaCl2反应产生沉淀
B.25℃时0.2mol·L-1HF溶液中pH=2
C.Ksp(CaF2)随温度和浓度的变化而变化
D.该体系中最终没有氟化氢分子
查看答案和解析>>
科目: 来源:2013届四川省高二下学期期中考试化学试卷(解析版) 题型:选择题
如图,隔板K可左右移动,甲中充入2 mol A和1
mol B,乙中充入2 mol C和1 mol He,此时K停在0处。发生反应2A(g)+B(g)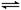 2C(g),达到平衡后,恢复至温度。下列有关说法不正确的是
2C(g),达到平衡后,恢复至温度。下列有关说法不正确的是
A.达平衡后,隔板K最终停留在左侧刻度0~2之间
B.若平衡时K停留在左侧1处,则活塞停留在右侧6处
C.达到平衡时,甲容器中B的物质的量小于于乙容器中B的物质的量
D.根据隔板K滑动与否可判断左右两边的反应是否达到平衡
查看答案和解析>>
科目: 来源:2013届四川省高二下学期期中考试化学试卷(解析版) 题型:填空题
在体积为1L的两个恒容密闭容器中,分别充入1molCO和1molH2O(g)的混合气体,进行如下化学反应:CO(g)+H2O(g) CO2(g)+H2(g),反应物CO的物质的量在不同温度时物质的量随时间的变化如下表所示,回答下列问题:
CO2(g)+H2(g),反应物CO的物质的量在不同温度时物质的量随时间的变化如下表所示,回答下列问题:
|
|
0min |
10min |
20min |
30min |
40min |
50min |
|
830℃ |
1mol |
0.8mol |
0.65mol |
0.55mol |
0.5mol |
0.5mol |
|
1100℃ |
1mol |
0.75mol |
0.6mol |
0.6mol |
0.6mol |
0.6mol |
(1)1100℃时,前10min该反应的化学反应速率v(CO2)= ,830℃平衡后CO转化率的为__________________。
(2)1100℃时化学平衡常数K=_______,该反应为________反应(填“吸热”和“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是____________________。
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O) (d)c(CO2)=c(CO)
(4)1100℃时达到平衡后,若向容器中再充入2molCO和2molH2O(g),平衡_____________________移动(选填“向正反应方向”或“向逆反应方向”或“不”),再达到平衡时,H2百分含量________________(选填“增大”或“减小”或“不变”)。
(5)830℃时,若在体积为2L的密闭容器中充入1molCO2和1molH2的混合气体,60min时反应达平衡状态,画出c(CO)和c(H2)随时间变化而变化的趋势图。
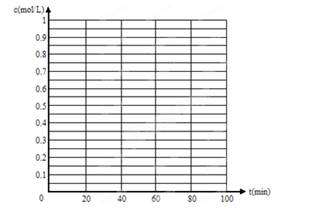
查看答案和解析>>
科目: 来源:2013届四川省高二下学期期中考试化学试卷(解析版) 题型:填空题
常温,向浓度为0.1mol/L,体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图像回答下列问题:
(1)氨水的电离方程式为 ,该温度时氨水的电离平衡常数K= 。
(2)比较b、c、d三点时的溶液中,水电离的c(OH-)大小顺序为 。
(3)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的有 。
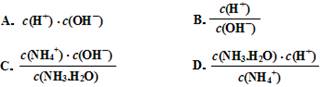
(4)根据以上滴定曲线判断下列说法正确的是(溶液中N元素只存在NH4+和NH3.H2O两种形式) 。
A.点b所示溶液中:c(NH4+)+c(H+)=c(NH3.H2O)+c(OH-)
B.点c所示溶液中:c(Cl-)=c(NH3.H2O)+c(NH4+)
C.点d所示溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.滴定中可能有:c(NH3.H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)
(5)滴定过程中所用盐酸的pH= ,d点之后若继续加入盐酸至图像中的e点(此时不考虑NH4+水解的影响),则e点对应的横坐标为 。
查看答案和解析>>
科目: 来源:2013届四川省高二下学期期中考试化学试卷(解析版) 题型:填空题
工业上制氯化铜无水物时,是将浓盐酸用蒸气加热至80 ℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁和SiO2),充分搅拌后使之溶解,制取流程如下:
 已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;常温时Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38。试回答:
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;常温时Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38。试回答:
(1)根据常温时Fe(OH)3的Ksp计算,当溶液中的Fe3+完全沉淀(此时溶液中的Fe3+物质的量的浓度=10-5mol/L),溶液的pH= 。
(2)溶液D制取无水CuCl2时,需在HCl气体中蒸干,原因是
。
(3)粗CuO溶于过量盐酸后,得到的溶液B中加入试剂x将Fe2+氧化为Fe3+,试剂x可以是 (填以下选项序号)。
A.KMnO4溶液 B.氯水 C.NaClO溶液 D.O3
若用H2O2溶液,则反应的离子方程式为 。
(4)溶液C加入试剂y,要调整溶液的pH至3-4,试剂y不能是 (填以下选项序号),原因是 。
A.NaOH溶液 B.Cu(OH)2固体 C.Cu2(OH)2CO3固体 D.CuO固体
(5)将ag粗CuO经过以上一系列操作之后,最终得到bg无水CuCl2(不考虑实验过程中操作引起的损耗),下列说法正确的是 。(NA表示阿伏伽德罗常数)
A.粗CuO中Cu2+数目小于
B.粗CuO中CuO物质的量小于 mol
mol
C.粗CuO中所含的铜元素的质量分数为 ×100℅
×100℅
D.粗CuO中关于CuO的量无法确定
查看答案和解析>>
科目: 来源:2013届四川省高二下学期期中考试化学试卷(解析版) 题型:填空题
A、B、C三种强电解质,它们溶于水在水中电离出的阳离子有K+、Ag+,阴离子有NO3-、OH-(电解质电离的离子有重复)。
图1装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为铂电极。接通电源,经过一段时间后,测得甲中b电极质量增加了43.2g。常温下各烧杯中溶液pH与电解时间t关系如图2。请回答下列问题:
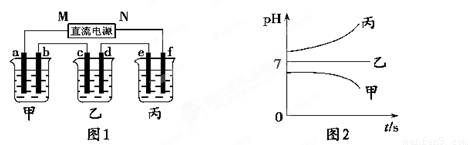
(1)写出三种强电解质的化学式:A ;B ;C 。
(2)写出乙烧杯c电极发生的电极反应为__________________________,甲烧杯中的总反应的化学方程式为___________________________________________。
(3)计算丙烧杯e电极上生成的气体在标准状况下的体积为________________,甲烧杯中溶液的pH= 。(假设溶液体积是400ml)
(4)要使甲烧杯中的A溶液恢复到电解前的状态,需要加入的物质是_____________,其质量为 。
(5)若直流电源使用的是铅蓄电池,铅蓄电池的正极材料是PbO2,负极材料是Pb,电解质溶液时H2SO4,则放电时N级上发生的电极反应为________________________________
____________________,M级附近溶液的pH (选填“升高”或“降低”或“不变”)。
铅蓄电池充电时,若阳极和阴极之间用阳离子交换膜(只允许H+通过)隔开,则当外电路通过0.2mol电子时,由阳极室通过阳离子交换膜进入阴极室的阳离子有 mol。
查看答案和解析>>
科目: 来源:2014届四川省高一下半期考试化学试卷(解析版) 题型:选择题
元素符号、反应方程式、结构示意图、电子式、结构式等通常叫做化学用语。
下列有关化学用语的表示方法中正确的是( )
A.H2O2的电子式:
B.NH4I的电子式 : 
C.原子核内有8个中子的碳原子:
D.CO2分子的结构式:O=C=O
查看答案和解析>>
科目: 来源:2014届四川省高一下半期考试化学试卷(解析版) 题型:选择题
下列有关原子结构和元素周期律表述正确的是( )
①原子序数为15的元素的最高化合价为+3
②ⅦA族元素是同周期中非金属性最强的元素
③第二周期ⅣA族元素的原子核电荷数和中子数一定为6
④原子序数为12的元素位于元素周期表的第三周期ⅡA族
A.①② B.①③ C.②④ D.③④
查看答案和解析>>
科目: 来源:2014届四川省高一下半期考试化学试卷(解析版) 题型:选择题
下列各组中化合物的性质比较,不正确的是( )
A.酸性:HClO4>HBrO4>HIO4 B.碱性:NaOH>Mg(OH)2>Al(OH)3
C.稳定性:PH3>H2S> HCl D.非金属性:F>O>S
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com