
科目: 来源:2013届云南省高二下学期期中考试化学试卷(解析版) 题型:填空题
(7分)A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大2,C原子的电子总数比B原子电子总数多4。1molA单质跟盐酸反应可置换出11.2L(标准状况下)氢气,这时A转变成与氖原子具有相同电子层结构的离子。试回答:
(1)A_________ B _________ C _________(填化学符号)
(2)分别写出A、B最高价氧化物对应水化物分别跟C的气态氢化物水溶液反应的离子方程式:________________________ ___________________________
(3)A离子的氧化性比B离子的氧化性_______(填“强”或“弱”),这是由于_____________.
查看答案和解析>>
科目: 来源:2013届云南省高二下学期期中考试化学试卷(解析版) 题型:填空题
(11分)Ⅰ.(1)0.02 mol·L-1的HCN溶液与0.02 mol·L-1 NaCN溶液等体积混合,已知该混合溶液中c (Na+)> c(CN-),用“>、<、=”符号填空
①溶液中c(OH -) c(H +) ② c(HCN) c(CN-)
(2)常温下,向Al2(SO4)3溶液中滴入Ba(OH)2溶液至Al3+ 刚好完全沉淀时,溶液pH 7,(填“>、<、=”)反应的离子方程式为_ ____________________________。
Ⅱ.依据氧化还原反应:MnO4-+5Fe2++8H+ = Mn2++5Fe3++4H2O,欲采用滴定的方法测定FeSO4的质量分数,实验步骤如下:
①称量FeSO4样品,配成100 mL待测溶液;
②取一定体积待测液置于锥形瓶中,并加入一定量的硫酸;
③将标准浓度的KMnO4溶液装入滴定管中,调节液面至a mL处;
④滴定待测液至滴定终点时,滴定管的液面读数b mL;
⑤重复滴定2~3次。
(1)如何知道滴定到达终点? _
下列操作会导致测定结果偏低的是 ___________
A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定
B.锥形瓶用蒸馏水洗涤后未用待测液润洗
C.读取标准液读数时,滴定前平视,滴定到终点后俯视
D.滴定前滴定管尖嘴处有气泡未排除,滴定后气泡消失
(2)下列每种量器的数量不限,在上述实验中,必须使用的有 ;
A.托盘天平 B.量筒 C.碱式滴定管 D.酸式滴定管
查看答案和解析>>
科目: 来源:2013届云南省高二下学期期中考试化学试卷(解析版) 题型:填空题
(10分)A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。

(1)写出下列物质的化学式:
A J
(2)按要求写方程式:
①C转化为I的离子方程式: 。
②F在空气中转化为G的化学方程式: 。
③D可以与水蒸气在高温条件下反应,写出此反应的化学方程式: 。
查看答案和解析>>
科目: 来源:2013届云南省高二下学期期中考试化学试卷(解析版) 题型:计算题
( 12分)一定温度下,将3 molA气体和1 molB气体通入一密闭容器中,发生如下反应:3A(g)+B(g)  xC(g),请填写下列空白:
xC(g),请填写下列空白:
(1)若容器体积固定为 2 L,反应1 min 时测得剩余1.8 mol A,C的浓度为0.4 mol/L。
①1 min内,B的平均反应速率为________;x为________。
②若反应经2 min达到平衡,平衡时C的浓度________0.8 mol/L(填“>、<、=”)
③平衡混合物中,C的物质的量占气体总物质的量的3/7,则A的转化率是________。
④改变起始物质加入的量,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应满足的关系式____ __________ __ _______。
(2)若维持容器压强不变,达到平衡时C的体积分数________(1)中平衡时C 的体积分数(填“>、<、=”);
查看答案和解析>>
科目: 来源:2013届云南省高二下学期期中考试化学试卷(解析版) 题型:填空题
(8分)如图A 为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:

(1)电源A上的a为________极;
(2)滤纸B上发生的总化学方程式为______________________;
(3)欲在电镀槽中实现铁上镀铜,接通K点,使c、d
两点短路,则电极e上发生的反应为________________,
电极f上发生的反应为______________________,槽中放的电镀液可以是__________(填一种电解质溶液即可)。
查看答案和解析>>
科目: 来源:2013届云南省高二下学期期末考试化学试卷(解析版) 题型:选择题
下列叙述正确的是( )
A.同一周期中,碱金属元素的第一电离能最大
B.同周期元素中,ⅦA族元素的原子半径最大
C.当各轨道处于全满、半满、全空时原子较稳定
D.ⅥA族元素的原子,其半径越大,越容易得到电子
查看答案和解析>>
科目: 来源:2013届云南省高二下学期期末考试化学试卷(解析版) 题型:选择题
下列关于分子或晶体中心原子的杂化类型的说法正确的是( )
A.CH3CH3中的两个碳原子与BF3中的硼原子均采取sp2杂化
B.晶体硅和石英晶体中的硅原子均采取sp3杂化
C.BeCl2中的铍原子和H2O中的氧原子均采取sp杂化
D.CO2中的碳原子与CH2=CH2中的两个碳原子均采取sp杂化
查看答案和解析>>
科目: 来源:2013届云南省高二下学期期末考试化学试卷(解析版) 题型:选择题
下列有关晶体的叙述中不正确的是( )
A.在晶体中只要有阴离子就一定有阳离子
B.1mol SiO2晶体中含2mol Si-O键
C.干冰晶体中每个CO2分子周围紧邻12个CO2分子
D.金刚石晶体中的最小环由6个碳原子构成
查看答案和解析>>
科目: 来源:2013届云南省高二下学期期末考试化学试卷(解析版) 题型:选择题
短周期主族元素A、B、C、D的原子序数依次增大;A、B、C原子的最外层电子数之和为12,B、C、D位于同一周期,C原子的最外层电子数既是A原子内层电子数的3倍又是B原子最外层电子数的3倍。下列说法正确的是( )
A.元素A、C的最高价氧化物对应的水化物都是弱酸
B.元素B能与A的最高价氧化物发生置换反应
C.元素B和D能形成BD2型的共价化合物
D.D的单质有毒,且有漂白性
查看答案和解析>>
科目: 来源:2013届云南省高二下学期期末考试化学试卷(解析版) 题型:选择题
下列文字表述与反应的离子方程式对应且正确的是( )
A.硫化钠的水解反应:S2-+H3O+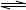 HS-+H2O
HS-+H2O
B.Fe3O4与足量稀HNO3反应:3Fe3O4+28H++NO3-=9Fe3++NO2↑+14H2O
C.NaHSO4溶液与Ba(OH)2溶液混合后显中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com