
科目: 来源:2011-2012年浙江宁波万里国际中学高二第二学期期中考试化学试卷(解析版) 题型:选择题
下列热化学方程式正确的是(注:ΔH的绝对值均正确)( )
A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-1 367.0 kJ·mol-1(燃烧热)
B.Ba(OH)2(aq)+2HCl(aq)===BaCl2(aq)+2H2O(l) ΔH=-57.3 kJ·mol-1(中和热)
C.S(s)+O2(g)===SO2(g) ΔH=-269.8 kJ·mol-1(反应热)
D.2NO2===O2+2NO ΔH=+116.2 kJ·mol-1(反应热)
查看答案和解析>>
科目: 来源:2011-2012年浙江宁波万里国际中学高二第二学期期中考试化学试卷(解析版) 题型:选择题
已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566kJ·mol-1
Na2O2(s)+CO2(g)===Na2CO3(s)+1/2O2(g) ΔH=-226 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是( )
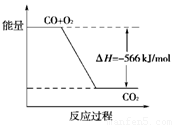
A.CO的燃烧热为283kJ
B.上图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g)ΔH>-452 kJ·mol-1
D.CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
科目: 来源:2011-2012年浙江宁波万里国际中学高二第二学期期中考试化学试卷(解析版) 题型:选择题
在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g) nY(g); ΔH=QkJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
nY(g); ΔH=QkJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:

下列说法正确的是( )
A.m>n
B.Q<0
C.温度不变,压强增大,Y的质量分数减小
D.体积不变,温度升高,平衡向逆反应方向移动
查看答案和解析>>
科目: 来源:2011-2012年浙江宁波万里国际中学高二第二学期期中考试化学试卷(解析版) 题型:选择题
一定温度下,容积为2 L的甲、乙两固定容积的密闭容器中,发生反应:
2SO2(g)+O2(g) 2SO3(g)。达平衡时测得有关数据如下表。
2SO3(g)。达平衡时测得有关数据如下表。
|
容 器 |
甲 |
乙 |
|
反应物投入量 |
2 mol SO2、1 mol O2 |
4 mol SO3 |
|
n(SO3)/mol |
1.6 |
a |
|
反应物的转化率 |
α1 |
α2 |
下列说法正确的是
A.α1+α2>1
B.1.6<a<3.2
C.若甲中反应2 min时达到平衡,则2 min 内平均速率ν(O2)= 0.1 mol·L-1·min-1
D.甲平衡后再加入0.2 mol SO2、0.2 mol O2和0.4 mol SO3,平衡正向移动
查看答案和解析>>
科目: 来源:2011-2012年浙江宁波万里国际中学高二第二学期期中考试化学试卷(解析版) 题型:选择题
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 
 2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始、平衡时的有关数据如下表所示:
2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始、平衡时的有关数据如下表所示:
|
容器编号 |
起始时各物质的物质的量/mol |
达平衡时体系能量的变化 |
||
|
N2 |
H2 |
NH3 |
||
|
① |
1 |
3 |
0 |
放出热量:23.15 kJ |
|
② |
0.9 |
2.7 |
0.2 |
放出热量:Q |
下列叙述错误的是 ( )
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为1/7
C.容器②中达平衡时放出的热量Q=23.15 kJ
D.若容器①的体积为0.5 L,则平衡时放出的热量小于23.15 kJ
查看答案和解析>>
科目: 来源:2011-2012年浙江宁波万里国际中学高二第二学期期中考试化学试卷(解析版) 题型:选择题
某密闭容器中发生如下反应:2X(g)+Y(g)
 Z(g);△H <0 下图是表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5
时刻外界条件有所改变,但都没有改变各物质的用量。则下列说法中不正确的是
Z(g);△H <0 下图是表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5
时刻外界条件有所改变,但都没有改变各物质的用量。则下列说法中不正确的是

A.t3 时减小了压强
B.t5 时增大了压强
C.t6 时刻后反应物的转化率最低
D.t1 ~ t2 时该反应的平衡常数大于 t6 时反应的平衡常数
查看答案和解析>>
科目: 来源:2011-2012年浙江宁波万里国际中学高二第二学期期中考试化学试卷(解析版) 题型:填空题
根据下列反应的焓变,计算C(石墨)与H2(g)反应生成1molC2H2(g)的焓变(△H)。
C(石墨)+ O2(g)=CO2(g) △H1=a kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=b kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=c kJ·mol-1
△H= 。
查看答案和解析>>
科目: 来源:2011-2012年浙江宁波万里国际中学高二第二学期期中考试化学试卷(解析版) 题型:填空题
A与B反应生成C,假定反应由A、B开始,它们的起始浓度均为1 mol.L-1。反应进行2min后,A的浓度为0.8 mol.L-1 ,B的浓度为0.6 mol.L-1 C的浓度为0.6 mol.L-1
(1)2min内反应的平均反应速率为:
ν(A)= ν(B)= ν(C)=
(2)ν(A)、ν(B)、ν(C) 三者之间的关系是:
(3)该反应的化学反应方程式:
查看答案和解析>>
科目: 来源:2011-2012年浙江宁波万里国际中学高二第二学期期中考试化学试卷(解析版) 题型:填空题
某课外活动小组同学用下图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题。
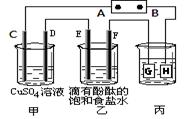
(1)A为电源的 极;
(2)E的电极反应式为: ;
(3)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 ;
(4)在常温下,现用丙装置给铁镀铜,则H电极材料应该是 ,
当丙中铁表面析出铜的3.2g时,乙中溶液的PH值为 (假设溶液体积为1L);
(5)在电解一段时间后在甲中加入适量 可以使溶液恢复到原来的浓度。
查看答案和解析>>
科目: 来源:2011-2012年浙江宁波万里国际中学高二第二学期期中考试化学试卷(解析版) 题型:填空题
乙醇脱水反应在不同温度条件下得到的产物组成不同。下表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应时间均相同。

已知:乙醇和乙醚(CH3CH2OCH2CH3)的沸点分别为78.4℃和34.5℃。请回答下列问题:
(1)乙醇脱水制乙烯的反应是________(填“放热”、“吸热”)反应,若增大压强,平衡_____________(选填“正向”、“逆向”、“不”)移动;
(2)已知:150℃时,1mol乙醇蒸汽脱水转变为1mol乙烯,反应热的数值为46KJ,写出该反应的热化学方程式____________________________________;
(3)写出乙醇脱水制乙醚的反应的平衡常数表达式________________。当乙醇起始浓度相同时,平衡常数K值越大,表明 (填字母)。
a.乙醇的转化率越高 b.反应进行得越完全
c.达到平衡时乙醇的浓度越大 d.化学反应速率越快
(4)根据表中数据分析,150℃时乙醇催化脱水制取的乙醚产量______(选填“大于”、“小于”、“等于”)125℃时;为了又快又多地得到产品,乙醇制乙醚合适的反应温度区域是______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com