
科目: 来源:2013届浙江湖州菱湖中学高二下学期期中考试化学试卷(解析版) 题型:选择题
在-50 ℃时液氨中有2NH3(液)  NH4++NH2—电离平衡关系,两离子的平衡浓度均为1×10-15mol·L-1,下列对-50 ℃时液氨的电离平衡常数的表达中正确的是
NH4++NH2—电离平衡关系,两离子的平衡浓度均为1×10-15mol·L-1,下列对-50 ℃时液氨的电离平衡常数的表达中正确的是
A.电离平衡常数是1×10-15
B.不加入其他物质,液氨中c(NH4+)=c(NH2—)
C.降低温度,其电离平衡常数数值增加
D.此液氨中放入NH4Cl,其电离平衡常数的数值增加
查看答案和解析>>
科目: 来源:2013届浙江湖州菱湖中学高二下学期期中考试化学试卷(解析版) 题型:选择题
室温时,下列混合溶液的pH一定小于7的是
A.pH=4的盐酸和pH=10的氨水等体积混合
B.pH=2的盐酸和pH=13的氢氧化钡等体积混合
C.pH=5的醋酸和pH=9的氢氧化钡等体积混合
D.pH=3的硫酸和pH=11的氨水等体积混合
查看答案和解析>>
科目: 来源:2013届浙江湖州菱湖中学高二下学期期中考试化学试卷(解析版) 题型:选择题
某溶液中仅含Na+、H+、OH-、CH3COO-四种离子,下列说法错误的是
A.溶液中四种粒子之间可能满足:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B.若溶液中部分粒子间满足:c(CH3COO-)=c(Na+)则该溶液一定呈中性
C.若溶液中溶质仅为CH3COONa,则粒子间一定满足:
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.若溶液中的溶质为CH3COONa和CH3COOH,则溶液中粒子间一定满足:
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目: 来源:2013届浙江湖州菱湖中学高二下学期期中考试化学试卷(解析版) 题型:选择题
在如图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g) 2C(g);△H<0。若起始温度相同,分别向三个容器中通入3molA和1mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为
2C(g);△H<0。若起始温度相同,分别向三个容器中通入3molA和1mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为
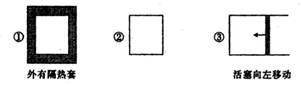
A. ③②① B.②①③ C.①②③ D.③①②
查看答案和解析>>
科目: 来源:2013届浙江湖州菱湖中学高二下学期期中考试化学试卷(解析版) 题型:选择题
蒸干氯化铁溶液后再加强热,得到的固体物质主要是
A.Fe2O3 B.FeCl3 C.FeCl3·H2O D.Fe(OH)3
查看答案和解析>>
科目: 来源:2013届浙江湖州菱湖中学高二下学期期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.用坩埚灼烧MgCl2·6H2O的反应式 MgCl2·6H2O MgCl2+6H2O
MgCl2+6H2O
B.根据下表提供的数据,等物质的量浓度的NaClO、NaHCO3混合溶液中,有c(HCO3-)>c(ClO-)>c(OH-)
C.常温下将pH=2的稀硫酸稀释10倍,其中各离子的物质的量浓度都变为原来的十分之一
D.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示,溶度积Ksp=c(Ba2+)·c(SO42-)。则加入Na2SO4可使溶液由a点变到b点;通过蒸发可以使溶液由d 点变到c 点
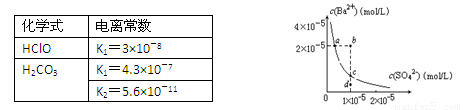
查看答案和解析>>
科目: 来源:2013届浙江湖州菱湖中学高二下学期期中考试化学试卷(解析版) 题型:填空题
可逆反应:aA(g) + bB(g)  cC(g)
+ dD(g) ΔH=Q;根据图回答:
cC(g)
+ dD(g) ΔH=Q;根据图回答:
① 压强 P1比P2 填(大或小)
② (a +b)比(c +d) 填(大或小)
③ 温度t1℃比t2℃ (高或低)
④ Q值为 填(正或负)(正值表示正反应吸热,负值表示正反应放热)

查看答案和解析>>
科目: 来源:2013届浙江湖州菱湖中学高二下学期期中考试化学试卷(解析版) 题型:填空题
(1)0.1mol/L Na2CO3溶液呈 (填“酸性”、“碱性”或“中性”),其原因是 (用离子方程式表示)
(2)氢氧燃料电池是利用氢能的一种重要方式。请写出氢氧燃料电池(电解质溶液为KOH溶液)的负极的电极反应式 ;
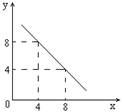
(3)某温度下的水溶液中,c(H+)=10-xmol/L,c(OH-)=10-y mol/L。x与y的关系如图所示,该温度下水的离子积为 ;该温度下0.01 mol/L NaOH溶液的pH为 。
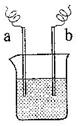
(4)如图装置,已知两电极上发生的电极反应分别为:
a极:Cu2++2e-= Cu b极:Fe-2e-= Fe2+
该装置中原电解质溶液一定含有 ;(填序号)
A. Cu2+ B.Na+ C.Fe2+ D. Ag+
(5)硫酸钡在水中存在沉淀溶解平衡:BaSO4(s)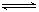 Ba2+ (aq)+ SO42-(aq) 25℃时,BaSO4的Ksp=1.1×l0—10,在0.1 mol·L一1硫酸溶液中,钡离子的浓度最大可达到 mol·L一1。
Ba2+ (aq)+ SO42-(aq) 25℃时,BaSO4的Ksp=1.1×l0—10,在0.1 mol·L一1硫酸溶液中,钡离子的浓度最大可达到 mol·L一1。
查看答案和解析>>
科目: 来源:2013届浙江湖州菱湖中学高二下学期期中考试化学试卷(解析版) 题型:填空题
某一元弱酸(用HA表示)在水中的电离方程式是:HA H++A-,回答下列问题:
H++A-,回答下列问题:
(1)向溶液中加入适量NaA固体,以上平衡将向 (填“正”、“逆”)反应方向移动,理由是 。
(2)若向溶液中加入适量NaCl溶液,以上平衡将向 (填“正”、“逆”、“不移动”)反应方向移动,溶液中c(A-)将 (填“增大”、“减小”或“不变”,下同),溶液中c(OH-)将 。
查看答案和解析>>
科目: 来源:2013届浙江湖州菱湖中学高二下学期期中考试化学试卷(解析版) 题型:填空题
物质在水中可能存在电离平衡、盐的水解平衡等,它们都可看作化学平衡。请根据所学的知识回答:
(1)A为0.1mol•L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为 。
(2)B为0.1 mol•L-1NaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(分别用离子方程式表示): ;实验测得NaHCO3溶液的pH>7,请分析NaHCO3溶液显碱性的原因: 。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入 ,目的是
;将B和C溶液混合后,反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com