
科目: 来源:2013届江苏省扬州市高二下学期期中考试化学试卷(解析版) 题型:填空题
(14分)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
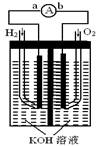
⑴氢氧燃料电池的能量转化主要形式是 ,
在导线中电子流动方向为 (用a、b 表示)。
⑵负极反应式为 。
⑶电极表面镀铂粉的原因为 。
⑷该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:Ⅰ. 2Li + H2  2LiH
Ⅱ. LiH
+ H2O == LiOH + H2↑
2LiH
Ⅱ. LiH
+ H2O == LiOH + H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
②已知LiH固体密度约为0.8g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
查看答案和解析>>
科目: 来源:2013届江苏省扬州市高二下学期期中考试化学试卷(解析版) 题型:填空题
(15分)研究NO2、SO2 、CO等大气污染气体的测量及处理具有重要意义。
⑴I2O5可使H2S、CO、HC1等氧化,常用于定量测定CO的含量。已知:
2I2(s) + 5O2(g)= 2I2O5(s) △H=-75.56 kJ·mol-1
2CO(g) + O2(g)= 2CO2(g) △H=-566.0 kJ·mol-1
写出CO(g)与I2O5(s)反应生成I2(s)和CO2(g)的热化学方程式: 。
⑵一定条件下,NO2与SO2反应生成SO3和NO两种气体。将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 ,
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO2的同时生成1 molNO
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K= 。
⑶从脱硝、脱硫后的烟气中获取二氧化碳,用二氧化碳合成甲醇是碳减排的新方向。将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)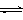 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
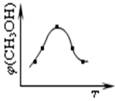
①取五份等体体积CO2和H2的的混合气体 (物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如图所示,则上述CO2转化为甲醇反应的△H3 0(填“>”、“<”或“=”)。
②在容积为1L的恒温密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如下左图所示。若在上述平衡体系中再充0.5 mol CO2和1.5 mol H2O(g) (保持温度不变),则此平衡将 移动(填“向正反应方向”、“不”或“逆反应方向”)
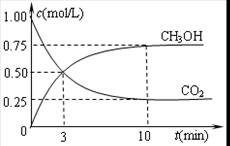
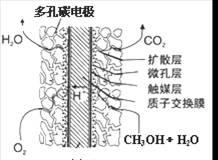
③直接甲醇燃料电池结构如上右图所示。其工作时负极电极反应式可表示为 。
查看答案和解析>>
科目: 来源:2013届江苏省扬州市高二下学期期中考试化学试卷(解析版) 题型:实验题
(12分)某校学生用中和滴定法测定某NaOH溶液的物质的量浓度,选甲基橙作指示剂。
⑴盛装0.2000 mol/L盐酸标准液应该用 式滴定管。
⑵滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视__ ,直到因加入一滴盐酸后,溶液由黄色变为橙色,并 为止。
⑶ 滴定操作可分解为如下几步:
①检查滴定管是否漏水
②取一定体积的待测液于锥形瓶中
③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管
④装标准溶液和待测液并调整液面(记录初读数)
⑤用蒸馏水洗涤玻璃仪器
⑥滴定操作
正确的操作顺序为: 。
⑷有关数据记录如下:
|
实验序号 |
待测液体积(mL) |
所消耗盐酸标准液的体积(mL) |
|
|
滴定前 |
滴定后 |
||
|
1 |
20.00 |
0.50 |
20.70 |
|
2 |
20.00 |
6.00 |
26.00 |
|
3 |
20.00 |
1.40 |
21.20 |
则NaOH溶液的物质的量浓度为______________mol/L。
⑸若只用蒸馏水冲洗锥形瓶,则测定结果_________________,若滴定前平视读数,滴定终点时俯视读数,则会使所测酸的浓度值 。(填“无影响”、“偏高”或“偏低”)。
查看答案和解析>>
科目: 来源:2013届江苏省扬州市高二下学期期中考试化学试卷(解析版) 题型:填空题
(13分)纳米氧化亚铜(Cu2O)是一种用途广泛的光电材料,常用的制备方法有电化学法、湿化学法等。电化学法可用铜棒和石墨作电极,电解Cu(NO3)2稀溶液制备。湿化学法的制备过程为:在KOH溶液中加入一定量的CuSO4溶液,再加入一定量的还原剂——肼(N2H4),加热并保持温度在90℃。检验反应完全后,分离、洗涤、真空干燥得到固体样品。反应方程式为:
4CuSO4 + N2H4 + 8KOH = 2Cu2O + N2↑+ 4K2SO4 + 6H2O
⑴电化学法制备Cu2O时,铜棒做 极,阴极生成Cu2O的电极反应式为 。
⑵湿化学法中,检验纳米Cu2O已经生成的实验方法是 。
⑶湿化学法得到的产品中常含有Cu。称取某产品1.76 g(设仅含Cu2O和Cu),加入足量的稀硝酸,充分反应后得到标准状况下的NO气体224mL,计算产品中Cu2O的质量分数。(写出计算过程)
查看答案和解析>>
科目: 来源:2014届江西省四校高一下学期期末联考化学试卷(解析版) 题型:选择题
若以NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.加热时1 mol Fe与1 mol Cl2能恰好完全反应生成1 mol FeCl2,转移电子数为2NA
B.标准状况下,22.4L己烷中含碳原子数为6NA
C.30g甲醛中含共用电子对总数为3NA
D.3.9g Na2O2 与3.1g Na2O组成的混合物中所含离子总数为0.3NA
查看答案和解析>>
科目: 来源:2014届江西省四校高一下学期期末联考化学试卷(解析版) 题型:选择题
已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:MnO4- → Mn2+ H2O2 → H2O HNO2 → NO IO3- → I2 如果用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
A.MnO4- B.H2O2 C.HNO2 D.IO3-
查看答案和解析>>
科目: 来源:2014届江西省四校高一下学期期末联考化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是( )
A.在蓝色的淀粉溶液中通入足量SO2后成无色溶液:I2+SO2+2H2O=2I-+SO32-+4H+
B.等物质的量的亚硫酸氢铵与氢氧化钠溶液混合:NH4++HSO3-+2OH-=SO32-+NH3↑+2H2O
C.碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO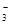 +Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓
+Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓
D.碳酸氢钠溶液中加入过量氢氧化钡溶液:HCO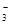 +Ba2++OH-=BaCO3↓+H2O
+Ba2++OH-=BaCO3↓+H2O
查看答案和解析>>
科目: 来源:2014届江西省四校高一下学期期末联考化学试卷(解析版) 题型:选择题
化学实验中经常要用到酸化的操作,下列有关酸化正确的有( )
①配制氯化铁溶液时,为防止其水解滴加少量硫酸酸化
②为提高KMnO4溶液的氧化性,滴加少量盐酸酸化
③检验Cl- 的存在时,为防止杂质离子的干扰,应选择硝酸酸化的AgNO3溶液
④检验SO42- 的存在时,为防止杂质离子的干扰,应选择硝酸酸化的BaCl2溶液
⑤检验氯乙烷中的氯元素时,将氯乙烷和NaOH溶液混合加热后,先用稀硫酸进行酸化
A.1项 B.2项 C.3项 D.4项
查看答案和解析>>
科目: 来源:2014届江西省四校高一下学期期末联考化学试卷(解析版) 题型:选择题
已知甲苯的一氯代物有4种同分异构体,则甲基环己烷的一氯取代物有( )
A.3种 B.4种 C.5种 D.6种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com