
科目: 来源:2013届海南省高二下学期期中考试化学试卷(解析版) 题型:选择题
25℃时,水的电离可达到平衡:H2O H++OH- △H>0,下列叙述正确的是(
)
H++OH- △H>0,下列叙述正确的是(
)
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C. 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D. 将水加热,Kw增大,pH不变
查看答案和解析>>
科目: 来源:2013届海南省高二下学期期中考试化学试卷(解析版) 题型:选择题
下列叙述正确的是( )
A.95℃纯水的pH<7,说明加热可导致水呈酸性
B.pH=3的醋酸溶液,稀释至10倍后pH=4
C.0.2 mol•L-1的盐酸,与等体积水混合后pH=1
D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7
查看答案和解析>>
科目: 来源:2013届海南省高二下学期期中考试化学试卷(解析版) 题型:填空题
(6分)依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___________________________________________。
(2)若适量的N2和O2完全反应,每生成23g NO2需要吸收16.95kJ热量
_______________________________________________________________。
(3)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________
查看答案和解析>>
科目: 来源:2013届海南省高二下学期期中考试化学试卷(解析版) 题型:填空题
(3分) 已知:
2Al
(s)+ O2(g)=== Al2O3(s) △H=
-1 644.3 kJ• mol-1
O2(g)=== Al2O3(s) △H=
-1 644.3 kJ• mol-1
2Fe
(s) + O2(g)=== Fe2O3(s)
△H= -815.88 kJ• mol-1
O2(g)=== Fe2O3(s)
△H= -815.88 kJ• mol-1
试写出铝粉与氧化铁粉末发生铝热反应的热化学方程式___________________________。
查看答案和解析>>
科目: 来源:2013届海南省高二下学期期中考试化学试卷(解析版) 题型:实验题
(14分) 下表是稀硫酸与某金属反应的实验数据:
|
实验序号 |
金属 质量/g |
金属状态 |
c(H2SO4) /mol·L-1 |
V(H2SO4) /mL |
溶液温度/℃ |
金属消失的时间/s |
|
|
反应前 |
反应后 |
||||||
|
1 |
0.10 |
丝 |
0.5 |
50 |
20 |
34 |
500 |
|
2 |
0.10 |
粉末 |
0.5 |
50 |
20 |
35 |
50 |
|
3 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
250 |
|
4 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
|
5 |
0.10 |
粉末 |
0.8 |
50 |
20 |
36 |
25 |
|
6 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
125 |
|
7 |
0.10 |
丝 |
1.0 |
50 |
35 |
50 |
50 |
|
8 |
0.10 |
丝 |
1.1 |
50 |
20 |
34 |
100 |
|
9 |
0.10 |
丝 |
1.1 |
50 |
30 |
44 |
40 |
分析上述数据,回答下列问题:
(1)实验4和5表明,_________对反应速率有影响,_________ 反应速率越快,能表明同一规律的实验还有_________(填实验序号);
(2)仅表明反应物浓度对反应速率产生影响的实验有_________(填实验序号);
(3)本实验中影响反应速率的其他因素还有_________ ,其实验序号是_________。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:
____________________________________。
查看答案和解析>>
科目: 来源:2013届海南省高二下学期期中考试化学试卷(解析版) 题型:计算题
(4分)
在密闭容器中,将2.0 mol CO与10mol H2O混合加热到800℃,达到下列平衡:CO(g)+H2O(g)
 CO2(g)+H2(g) K=1.0,则CO的转化率为________
CO2(g)+H2(g) K=1.0,则CO的转化率为________
在800℃,若上述反应体系中各物质的浓度分别为c(CO)=2.0mol•L-1,c(H2O)=6.0mol•L-1,c(CO2)=3.0mol•L-1,c(H2)= 4.5mol•L-1,则此时该反应向_________ 方向移动。
查看答案和解析>>
科目: 来源:2013届海南省高二下学期期中考试化学试卷(解析版) 题型:填空题
(14分) 反应A(g)+B(g)
 C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
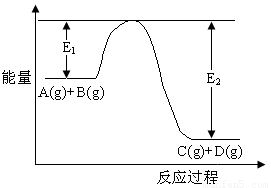
(1)该反应是__________反应(填“吸热”“放热”);
(2)当反应达到平衡时,升高温度,A的转化率________(填“增大”“减小”“不变”),原因是______________________________________________。
(3)反应体系中加入催化剂对反应热是否有影响?______________________,原因是_______________________________________________________;
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_______,E2_______(填“增大”“减小”“不变”)。
查看答案和解析>>
科目: 来源:2013届海南省高二下学期期中考试化学试卷(解析版) 题型:填空题
(9分)25℃时,有0.01 mol•L-1的醋酸溶液,试回答下列问题:
(1)写出醋酸的电离平衡常数表达式
(2)达平衡时,溶液中氢离子浓度是多少?(25℃时,醋酸的电离平衡常数为1. 75×10 -5)
(3)当向该溶液中加入一定量的盐酸时,溶液中的c(H+)、c (CH3COO-)、c (CH3COOH) 是否又发生变化? 电离常数是否发生变化? 为什么 ?
查看答案和解析>>
科目: 来源:2013届海南省高二下学期期中考试化学试卷(解析版) 题型:计算题
(8分) 某温度(t℃)时,水的KW=10-13,则该温度(填大于、等于或小于)
(1)_____25℃,理由是_________________________________________________,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,
(2)若所得混合溶液为中性,则a:b=_________;
(3)若所得混合溶液pH=2,则a:b=__________。
查看答案和解析>>
科目: 来源:2014届海南省高一下学期期中考试化学试卷(解析版) 题型:选择题
月球的土壤中含有较丰富的质量数为3的氦,它可以作为未来核聚变的重要原料之一。氦的该种核素为
A.1 1He B.3 2He C.5 2He D.1 2He
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com