
科目: 来源:2011-2012学年江苏省高三高考压轴化学试卷(解析版) 题型:填空题
(12分)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下两种方法:
I.还原法 在酸性介质中用FeSO4等将+6价铬还原成+3价铬。具体流程如下:

有关离子完全沉淀的pH如下表:
|
有关离子 |
Fe2+ |
Fe3+ |
Cr3+ |
|
完全沉淀为对应氢氧化物的pH |
9.0 |
3.2 |
5.6 |
(1)写出Cr2O72―与FeSO4溶液在酸性条件下反应的离子方程式__________________。
(2)还原+6价铬还可选用以下的________________试剂(填序号)。
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
则在操作②中可用于调节溶液pH的试剂为:_____________(填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
此时调节溶液的pH范围在____________(填序号)最佳。
A.3~4 B.6~8 C.10~11 D.12~14
II.电解法 将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去。
(4)写出阴极的电极反应式______________________________________。
(5)电解法中加入氯化钠的作用是:_______________________________________。
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三高考压轴化学试卷(解析版) 题型:填空题
(1)钒触媒(V2O5)能加快SO2的氧化速率,此过程中SO2先与V2O5反应生成V2O4。该过程的化学方程式可表示为__________________________________________。
(2)为测定过程中混合气的SO2体积分数,选用0.0500 mol/L I2的标准溶液、淀粉溶液进行测定。已知:V(耗用I2标准溶液)=10.00 mL,V(采集烟气)=100.0 mL(已折算为标准状况),则烟气中SO2 的体积分数为_____________________。
(3)一定温度时,SO2的平衡转化率(α)与体系总压强(p)的关系如图9所示。试分析工业生产中采用常压的原因是____________________。

图9
(4)在温度相同、体积均为1 L的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。
已知:2SO2(g)+O2(g) 2SO3(g) ΔH =-98.3 kJ·mol-1。
2SO3(g) ΔH =-98.3 kJ·mol-1。
|
容 器 |
甲 |
乙 |
丙 |
|
反应物投入量 |
2 mol SO2、1 mol O2 |
2 mol SO3 |
m mol SO2、n mol O2、 p mol SO3 |
|
c(SO3) /mol·L-1 |
1.4 |
1.4 |
1.4 |
|
能量变化 |
放出a kJ |
吸收b kJ |
吸收c kJ |
|
SO2或SO3的转化率 |
α1 |
α2 |
12.5% |
则:α1+α2=_________________,p=________________mol,b+c=_______________kJ 。
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三高考压轴化学试卷(解析版) 题型:填空题
(14分)碳酸锶广泛应用于电子工业。以天青石(主要成分为SrSO4)为基本原料制备碳酸锶。
(1)碳还原法制备。
①已知:SrSO4(s) + 4C(s)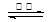 4CO(g) + SrS(s) △H = +a
kJ·mol-1
4CO(g) + SrS(s) △H = +a
kJ·mol-1
SrSO4(s)
+ 2C(s)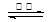 2CO2(g) + SrS(s) △H=+b
kJ·mol-1
2CO2(g) + SrS(s) △H=+b
kJ·mol-1
则:反应C(s) +
CO2(g)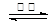 2CO(g)的△H= ___________kJ·mol-1。
2CO(g)的△H= ___________kJ·mol-1。
②SrS是强碱弱酸盐,热水中发生水解的化学反应方程式为_______________________。
③水解所得Sr(OH) 2与NH4HCO3按照物质的量比1:1投料制备SrCO3,则化学反应方程式为__________________________________________________。
(2)湿法制备。(已知:Ksp(SrSO4)=3.2×10-7,Ksp(SrCO3)=1.1×10-10。)
①将天青石矿粉与Na2CO3溶液搅拌混匀、加热,发生的离子反应方程式为: ____________。
②当转化完成时,混合液中c(CO32-)= 1.0×10-3mol/L,c(SO42-)=______________mol/L。
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三高考压轴化学试卷(解析版) 题型:实验题
(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.《物质结构与性质》2010年上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED)。目前市售LED品片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主。砷化镓的品胞结构如图10。试回答:
图10
(1)镓的基态原子的电子排布式是 。
(2)砷化镓品胞中所包含的砷原子(白色球)个数为 ,与同一个镓原子相连的砷原子构成的空间构型为 。
(3)下列说法正确的是 (填字母)。
A.砷化镓品胞结构与NaCl相同
B.第一电离能:As>Ga
C.电负性:As>Ga
D.砷化镓晶体中含有配位键
E.GaP与GaAs互为等电子体
(4)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是 。
(5)砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式
为 。
B.《实验化学》某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
⑴提出假设
①该反应的气体产物是CO2。
②该反应的气体产物是CO。
③该反应的气体产物是 。
⑵设计方案 如图11所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。

图11
⑶查阅资料
氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。
请写出该反应的离子方程式: 。
⑷实验步骤
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。
步骤②、④中都分别通入N2,其作用分别为 。
⑸数据处理
试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式 。 ⑹实验优化 学习小组有同学认为应对实验装置进一步完善。
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是 。
②从环境保护的角度,请你再提出一个优化方案: 。
查看答案和解析>>
科目: 来源:2011-2012学年河北省冀州市高三联排考试化学试卷(解析版) 题型:选择题
下列说法错误的是 ( )
A.如果设“此”为电解质,“彼”为非电解质,不是所有的物质都是非此即彼的;
B.不是所有反应,都遵循由强(如强酸、强碱、强氧化剂或强还原剂等)制弱(如弱酸、弱碱、弱氧化剂 或弱还原剂等)的规律;
C.不是所有自发进行的反应都一定是焓减的过程;
D.在迄今发现的元素中,不一定所有非金属元素(稀有气体除外)都满足条件‘ 主族元素的族序数≥其周期序数’
查看答案和解析>>
科目: 来源:2011-2012学年河北省冀州市高三联排考试化学试卷(解析版) 题型:选择题
下列实验描述,不正确的是 ( )
A.同样是在氯气中点燃,铁少量生成的是氯化铁,过量时则生成氯化亚铁
B.同样是试纸检测,检验气体需要润湿,检验溶液时则一般不能润湿
C.同样是配制溶液,一定质量分数的溶液配制使用烧杯,而一定物质的量浓度的溶液配制则还需要容量瓶
D.同样是浓溶液(设其质量分数为ω )与水等体积混合,所得硫酸的浓度大于 0.5ω ,氨水的则小于 0.5ω
查看答案和解析>>
科目: 来源:2011-2012学年河北省冀州市高三联排考试化学试卷(解析版) 题型:选择题
下列说法不正确的是 ( )
A.分子式为C9H10的含苯环的烯烃(不考虑立体异构)共有6种
B.芥子醇(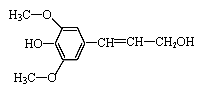 ) 能发生氧化、取代、水解、加聚反应
) 能发生氧化、取代、水解、加聚反应
C.实验室制乙烯时,把生成的气体通入酸性KMnO4溶液,紫色褪去,不能说明一定生成了乙烯
D.将少量某物质的溶液滴加到新制银氨溶液中,水浴加热后有银镜生成,该物质不一定属于醛类
查看答案和解析>>
科目: 来源:2011-2012学年河北省冀州市高三联排考试化学试卷(解析版) 题型:选择题
某温度下 H2(g)+I2(g) 2HI(g)的平衡常数K=O.25 ,
该温度下在甲、乙、丙三个恒容密闭容器中充入H2
(g)、 I2 (g),起始浓度如下表所示:
2HI(g)的平衡常数K=O.25 ,
该温度下在甲、乙、丙三个恒容密闭容器中充入H2
(g)、 I2 (g),起始浓度如下表所示:
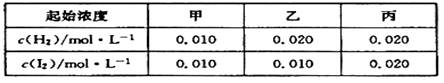
下列判断不正确的是( )
A. 平衡时甲中和丙中H2的转化率相同
B. 平衡时乙中I2的转化率小于40%
C. 平衡时乙中c(HI)比甲中的2倍大
D.反应平衡时,丙中气体颜色最深,乙中气体颜色最浅
查看答案和解析>>
科目: 来源:2011-2012学年河北省冀州市高三联排考试化学试卷(解析版) 题型:选择题
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用上图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。下列正确的是:( )
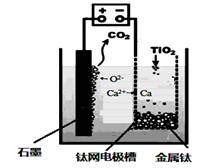
A.由TiO2制得1mol 金属Ti ,理论上外电路转移2NA电子
B.阳极的电极反应式为:C + 2O2- - 4e- == CO2↑
C.若用铅蓄电池作该装置的供电电源,“ +”接线柱应连接Pb电极
D.在制备金属钛前后,整套装置中CaO的总量减少
查看答案和解析>>
科目: 来源:2011-2012学年河北省冀州市高三联排考试化学试卷(解析版) 题型:选择题
对于体积相同的①(NH4) 2SO4、②NH4HSO4、③H2SO4溶液,下列说法正确的是 ( )
A.溶液的pH相同时,3种溶液物质的量浓度大小顺序是③>②>①
B.溶液的pH相同时,将3种溶液稀释相同倍数,pH变化最大的是①
C.溶液的pH相同时,由水电离出的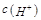 大小顺序是③>②>①
大小顺序是③>②>①
D.若3种溶液的物质的量浓度都相同,则溶液的pH大小顺序是①>②>③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com