
科目: 来源:2011-2012学年江苏省高三高考压轴化学试卷(解析版) 题型:选择题
下列离子方程式与所述事实相符且正确的是
A.由FeCl3溶液制取Fe(OH)3胶体:Fe3+ + 3H2O
 Fe(OH)3胶体 + 3H+[来源:学_科_网Z_X_X_K]
Fe(OH)3胶体 + 3H+[来源:学_科_网Z_X_X_K]
B.小苏打与氢氧化钠溶液混合:HCO3- + OH- = CO2↑+H2O
C.向明矾溶液中加入过量的氢氧化钡溶液:Al3+ + SO42- + Ba2+ + 4OH- = BaSO4↓ + AlO2- + 2H2O
D.向水玻璃中通足量CO2:SiO32- + CO2 + H2O = H2SiO3↓ + HCO3-
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三高考压轴化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.c(OH-)/c(H+)=1012的溶液中:SO32-、NH4+、NO3-、K+
B.c(I-)=0.1 mol·L-1的溶液中:Na+、NH4+、ClO-、SO42-
C.加入Mg能放出H2的溶液:Na+、Al3+、Cl-、SO42-
D.加入苯酚显紫色的溶液:NH4+、K+、Cl-、S2-
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三高考压轴化学试卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是
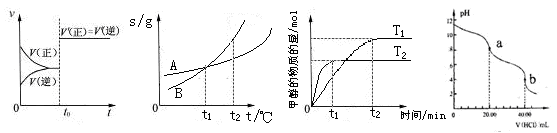 图4
图5
图6
图7
图4
图5
图6
图7
A.图4表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂
B.图5表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
C.图6表示在其他条件相同时,分别在T1、T2温度下由CO2和H2合成甲醇的物质的量随时间变化情况,则CO2和H2合成甲醇是吸热反应
D.图7是用0.1000mol/L的盐酸滴定20.00mLNa2CO3溶液的曲线,从a→b点反应得离子方程式为:HCO3- + H+ = CO2↑ + H2O
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三高考压轴化学试卷(解析版) 题型:选择题
有A、B、C、D、E、五种短周期元素,A元素原子的最外层电子数比次外层多4个,B元素有3种同位素B1、B2、B3、,B3原子的质量数是B1的3倍,C是非金属性最强的元素,D和C可以形成DC型离子化合物,且离子的电子层结构相同,E的气态氢化物水溶液显碱性而其最高价氧化物对应的水化物为强酸。下列说法正确的是
A.A和B可以形成原子个数比1:1的化合物
B.离子半径:D+ > C-
C.以上元素中形成的最高价氧化物对应的水化物酸性最强的是C
D.A、C、E三种元素气态氢化物的熔沸点都高于各自同主族元素气态氢化物的熔沸点
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三高考压轴化学试卷(解析版) 题型:选择题
绿原酸是一种有降压作用的药物,可由咖啡酸(一种芳香酸)与奎尼酸通过酯化反应合成。下列说法正确的是
A.奎尼酸分子式为C7H12O6
B.1mol奎尼酸与NaOH溶液反应,最多消耗5molNaOH
C.绿原酸能发生取代、加成、消去和缩聚反应
D.咖啡酸和奎尼酸都能与FeCl3溶液发生显色反应
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三高考压轴化学试卷(解析版) 题型:选择题
下列有关溶液中微粒的物质的量浓度关系正确的是
A.某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-)
B.物质的量浓度相等的①NH4HCO3溶液、②NH4Cl溶液、③NH4HSO4溶液中,c(NH4+)的大小关系:①>②>③
C.0.1 mol·L-1 CH3COONa 溶液与0.05 mol·L-1盐酸等体积混合后的酸性溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
D.0.1mol·L-1(NH4)2Fe(SO4)2溶液中: c(NH4+)+ c(NH3·H2O) + c(Fe2+)=0.3 mol·L-1
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三高考压轴化学试卷(解析版) 题型:选择题
下图是一种染料敏化太阳能电池的示意图。电池的一个点极由有机光敏燃料(S)涂覆在TiO2纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为:
 (激发态)
(激发态)



 图8
图8
下列关于该电池叙述正确的是:
A.电池的电解质溶液中I-的浓度减少
B.电池工作时,是将太阳能转化为电能
C.电池中镀铂导电玻璃为正极
D.电池工作时,I-离子在镀铂导电玻璃电极上放电
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三高考压轴化学试卷(解析版) 题型:选择题
在容积为2 L的3个密闭容器中发生反应3A(g)+B(g) xC(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
xC(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
|
容器 |
甲 |
乙 |
丙 |
|
反应物投入量 |
3 mol A、2 mol B |
6 mol A、4 mol B |
2 mol C |
|
到达平衡的时间(min) |
5 |
|
8 |
|
A的浓度(mol/L) |
c1 |
c2 |
|
|
C的体积分数 |
w1 |
|
w3 |
|
混合气体密度(g/L) |
ρ1 |
ρ2 |
|
下列说法正确的是
A.若x<4,则2c1>c2
B.若w3=w1,可断定x=4
C.无论x的值是多少,均有2ρ1=ρ2
D.容器甲中反应从开始到达平衡平均速率为v(A)=0.3 mol·L-1·min-1
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三高考压轴化学试卷(解析版) 题型:填空题
(12分)菱锰矿的主要成分是碳酸锰,还含 Fe2O3、FeO 、CaO、MgO 等成分。某化工厂用废盐酸(质量分数约20%)与菱锰矿制备MnCl2·4H2O(106℃时失去一分子结晶水,198℃时失去全部结晶水而成无水物),部分工艺流程如下:

(1)废盐酸与菱镁矿中碳酸锰反应的化学方程式为:_______________________________。
(2)酸浸时,浸出时间对锰浸出率的影响如右图,工业采用的是浸取60min,其可能原因是:____________________________________________________。
(3)图中“净化剂X”可能是________________________。
(4)过滤4获得的盐Y,其主要成分是__________________________。
(5)浓缩结晶时,必须一出现晶膜立刻停止加热,其原因是:_______________________。
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三高考压轴化学试卷(解析版) 题型:填空题
15分)苄佐卡因是一中医用麻醉药品,学名对氨基苯甲酸乙酯,它以对硝基甲苯为主要起始原料经下列反应制得:
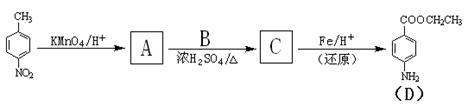
请回答下列问题:
(1)写出A、B、C的结构简式:A 、B 、C 。
(2)用1H核磁共振谱可以证明化合物C中有 种氢处于不同的化学环境。
(3)写出同时符合下列要求的化合物C的所有同分异构体的结构简式(E、F、G除外)
①化合物是1,4-二取代苯,其中苯环上的一个取代基是硝基
②分子中含有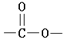 结构的基团
结构的基团
注:E、F、G结构如下:
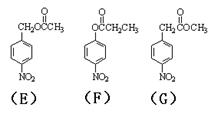
(4)E、F、G中有一化合物经酸性水解,其中的一种产物能与FeCl3溶液发生显色反应,写出该水解反应的化学方程式 。
(5)已知:
①
②
写出以苯酚钠、CH3CH2OH、(CH3CO)2O为原料合成 的流程图(无机试剂任选)。合成路线流程图示如下:
的流程图(无机试剂任选)。合成路线流程图示如下:
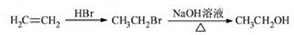
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com