
科目: 来源:2011-2012年福建漳州芗城中学高二下学期期中考试文科化学试卷(解析版) 题型:选择题
下列四个试管中,过氧化氢分解产生氧气的反应速率最大的是 ( )
|
试管 |
温度 |
过氧化氢溶液浓度 |
催化剂 |
|
A |
常温 |
3% |
—— |
|
B |
常温 |
6% |
—— |
|
C |
水浴加热 |
3% |
—— |
|
D |
水浴加热 |
6% |
MnO2 |
【解析】考查外界条件对反应速率的影响。一般情况下,温度越高,反应物的浓度越大,反应速率越大。使用催化剂可以加快反应速率,所以选项D是正确的,答案选D。
查看答案和解析>>
科目: 来源:2011-2012年福建漳州芗城中学高二下学期期中考试文科化学试卷(解析版) 题型:填空题
(4分)人们一日三餐的主食由大米、面粉等制作而成,其主要成分是 。医疗上常用作“钡餐”的是 (填" 硫酸钡”或"碳酸钡")。
【解析】大米、面粉等属于糖类,主要成分是淀粉。“钡餐”指的是硫酸钡。
查看答案和解析>>
科目: 来源:2011-2012年福建漳州芗城中学高二下学期期中考试文科化学试卷(解析版) 题型:填空题
(12分)下表是元素周期表的一部分,针对所给的11种元素,完成下列各小题。

(1)化学性质最不活泼的元素是 (填元素名称);
(2)Cl原子结构示意图为 ;
(3)第三周期元素中,最高价氧化物对应水化物碱性最强的是 (填化学式);
(4)O和N中,原子半径较大的是 ;
(5)“高钙牛奶”中的钙是指 (填“元素”或“单质”);
(6)Cl的气态氢化物的稳定性比F的气态氢化物 (填强或弱);
(7)常温下为红棕色气体的氧化物的化学式是 。
(8)镁是一种重要的金属材料,工业上采用电解熔融氯化镁获得金属镁,该反应的化学方程式为 ;
(9)S元素形成的一种氢化物的化学式是 ,该物质中H元素与S元素的质量比
m(H):m(S)= 。(相对原子质量:H-1 S-32)
【解析】考查元素周期表的结构和元素周期律的应用。根据元素在周期表中的位置可知最不活泼的应该是稀有气体元素Ar;Cl属于第三正确第 ⅦA,所以其原子结构示意图为 ;同周期元素自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。在第三周期中最活泼的金属是Na,所以氢氧化钠的碱性最强,N的原子半径大于O的原子半径;牛奶是混合物,所以“高钙牛奶”中的钙是指元素,而不是单质;同主族元素自上而下非金属性逐渐减弱,金属性逐渐增强,氯化氢的稳定性弱于氟化氢的;常温下为红棕色气体的氧化物的化学式是NO2;电解熔融氯化镁生成物是镁和氯气;S是第ⅥA,最低价是-2价,所以氢化物的化学式为H2S,其中H元素与S元素的质量比是(1×2)︰32=1︰16。
;同周期元素自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。在第三周期中最活泼的金属是Na,所以氢氧化钠的碱性最强,N的原子半径大于O的原子半径;牛奶是混合物,所以“高钙牛奶”中的钙是指元素,而不是单质;同主族元素自上而下非金属性逐渐减弱,金属性逐渐增强,氯化氢的稳定性弱于氟化氢的;常温下为红棕色气体的氧化物的化学式是NO2;电解熔融氯化镁生成物是镁和氯气;S是第ⅥA,最低价是-2价,所以氢化物的化学式为H2S,其中H元素与S元素的质量比是(1×2)︰32=1︰16。
查看答案和解析>>
科目: 来源:2011-2012年福建漳州芗城中学高二下学期期中考试文科化学试卷(解析版) 题型:填空题
(6分)
(1)Na与水反应的化学方程式是: 。
(2) 由Al与Fe2O3组成的铝热剂常用于焊接铁轨。Al与Fe2O3混合强热反应的的化学方程式为: 。
【解析】考查常见方程式的书写。钠和水反应的生成物是氢气和氢氧化钠;铝和氧化铁的铝热反应的生成物是铁和氧化铝。
查看答案和解析>>
科目: 来源:2011-2012年福建漳州芗城中学高二下学期期中考试文科化学试卷(解析版) 题型:填空题
(6分)从A.甲烷 B.甲醛 C.油脂 D.乙醇 E.乙酸 F.葡萄糖等六种有机物中选择合适的答案,将其标号填在空格内。
(1)医疗消毒常用75%(体积分数)的 。
(2)能用于除去热水瓶胆水垢〔主要成分:CaCO3 , Mg(OH)2〕的是 。
(3)最简单的有机物是 。
(4)工业上制备肥皂的主要原料是 。
(5)糖尿病患者的尿液中含有 ,该物质的溶液与新制Cu(OH)2悬浊液共热,产生 (填“蓝色”或“砖红色”)沉淀。
【解析】(1)考查乙醇的用途
(2)可利用乙酸的酸性来除去水垢
(3)最简单的有机物是甲烷
(4)油脂通过皂化反应即可以制取肥皂
(5)葡萄糖中含有醛基,能被新制的氢氧化铜悬浊液氧化生成羧基,而氢氧化铜被还原生成砖红色的氧化亚铜沉淀。
查看答案和解析>>
科目: 来源:2011-2012年福建漳州芗城中学高二下学期期中考试文科化学试卷(解析版) 题型:实验题
(6分)某氧化铝样品中含有氧化铁和二氧化硅杂质,现欲制取纯净的氧化铝,某同学设计如下的实验方案。回答下列问题:
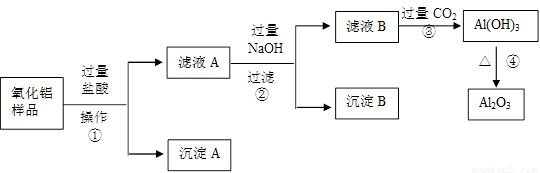
(1)操作①的名称 ;
(2)沉淀A的化学式是___________,滤液B中的阴离子除了Cl—、OH—外还有______________;
(3)步骤④的化学方程式为______________________________________;
(4)在操作②中要用到的玻璃仪器除了烧杯、玻璃棒,还有_________________。
【解析】二氧化硅不溶于盐酸,通过过滤即得到沉淀A。滤液中含有的是过量的盐酸,生成的氯化铁和氯化铝。加入过量的氢氧化钠溶液后氯化铁生成氢氧化铁沉淀,氯化铝生成偏铝酸钠,过滤即得到氢氧化铁沉淀。此时滤液中含有过滤的氢氧化钠和生成偏铝酸钠以及氯化钠,通入过量的二氧化碳即可以生成氢氧化铝沉淀。氢氧化铝不稳定,加热分解生成氧化铝。
查看答案和解析>>
科目: 来源:2011-2012年福建漳州芗城中学高二下学期期中考试文科化学试卷(解析版) 题型:填空题
(6分)简要回答下列问题。
(1) 长期存放石灰水的试剂瓶内壁会出现一层白色固体,请解释这一现象:
。
(2) 医疗上,小苏打常用作治疗胃酸过多的一种药剂,其理由是: 。
(3) 能源的紧缺在很大程度上制约了我省的经济发展,请你提出解决我省能源紧缺问题的两点建议:: 。
【解析】(1)氢氧化钙属于强碱,易吸水空气中的二氧化碳,生成碳酸钙白色沉淀
(2)小苏打是碳酸氢钠,显若碱性,能和酸反应,消耗氢离子
(3)由于化石燃料是不可再生的,且储藏量是有限,所以必须寻找新能源以代替化石燃料。同时必须通过燃料的燃烧效率,提供燃烧的利用率。
查看答案和解析>>
科目: 来源:2011-2012年福建漳州芗城中学高二下学期期中考试文科化学试卷(解析版) 题型:填空题
(4分)为了达到下表所列的实验要求,请选择合适的化学试剂或方法,将其标号填入对应的空格中。
|
实验要求 |
化学试剂 |
|
除去FeCl2溶液中少量FeCl3 |
|
|
区别羊毛线和晴纶线 |
|
|
除去餐具上的油污 |
|
|
检验淘米水中是否含有淀粉 |
|
供选择的化学试剂和方法
A.灼烧,闻气味 B.热的纯碱溶液 C.加入足量铁粉 D.碘水
【解析】铁离子能溶解单质铁生成亚铁离子,所以除去FeCl2溶液中少量FeCl3可以加入铁粉;羊毛的主要成分是蛋白质,晴纶是合成纤维,可以通过灼烧的方法来区分;油污的成分是油脂,难溶于水,但在碱性条件下容易发生水解反应,生成易溶于水的物质;检验淀粉的存在可用碘水,因为碘遇淀粉显蓝色。
查看答案和解析>>
科目: 来源:2011-2012年福建漳州芗城中学高二下学期期中考试文科化学试卷(解析版) 题型:实验题
(12分)下表是甲城市某日空气质量报告:
|
城市 |
污染指数 |
首要污染物 |
空气质量级别 |
空气质量状况 |
|
甲 |
55 |
SO2 |
II |
良 |
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行探究。
【探究实验】
实验一:用下图所示装置进行实验。

①A装置的作用是 (填“干燥”或“氧化”)SO2气体。
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变 色,说明SO2与水反应生成一种酸,该酸的化学式是 。
③D装置的作用是 。若实验中向装置内通入标准状况下2.24L SO2气体,且NaOH溶液过量。最多能生成Na2SO3的物质的量为 mol。(反应的化学方程式为:SO2+2NaOH=Na2SO3+H2O)
实验二:往盛有水的烧杯中通入SO2气体,测得所得溶液的显 性(“酸”“碱”“中”),然后每隔1 h测定其pH,发现pH逐渐变小,直至恒定。说明烧杯中溶液被空气中的氧气氧化最终生成H2SO4。
【查阅资料】SO2形成酸雨的另一途径; SO2与空气中的O2在飘尘的作用下反应生成SO3,
SO3溶于降水生成H2SO4。在此过程中飘尘作 。(填“氧化剂”或“催化剂”)
【探究结论】SO2与空气中的氧气、水反应生成硫酸而形成酸雨。本市可能易出现酸雨。
【知识联想】
(1)酸雨造成的危害是: (举一例)。
(2)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为 ,是造成酸雨的另一主要原因。
【提出建议】本市汽车数量剧增,为了减少汽车尾气造成的污染,建议市政府推广使用混合型汽油,即往汽油中按一定比例加入 (填“水”或“乙醇”)。
【解析】实验一:要检验二氧化硫能否使干燥的试纸变色,就需要事先干燥二氧化硫,即浓硫酸是用来干燥二氧化硫的;二氧化硫是酸性氧化物和水反应生成亚硫酸,亚硫酸是二元弱酸,具有酸的通性;由于二氧化硫属于大气污染物,需要进行尾气处理,氢氧化钠易吸收二氧化硫。2.24L SO2气体是 ,根据硫原子守恒可知Na2SO3的物质的量也是0.1mol。
,根据硫原子守恒可知Na2SO3的物质的量也是0.1mol。
实验二:SO2与空气中的O2在飘尘的作用下反应生成SO3的过程中,飘尘参与反应,但反应前后并没有发生变化,其飘尘的存在,加速了反应的进程,所以是催化剂,氧气才是氧化剂;氮的氧化物一般是NO或NO2,它们在水中最终转化为硝酸;水不能燃烧,不能加水。乙醇是可燃物,且燃烧产物不含造成污染,所以可以加入乙醇。
查看答案和解析>>
科目: 来源:2011-2012年福建漳州芗城中学高二下学期期中考试理科化学试卷(解析版) 题型:选择题
按能量由低到高的顺序排列,正确的一组是( )
A.1s、2p、3d、4s B.1s、2s、3s、2p C.2s、2p、3s、3p D.4p、3d、4s、3p
【解析】考查构造原理。根据核外电子的运动特点和构造原理可知能量由低到高的排列顺序为1s、2s、2p、3s、3p、4s、3d、4p、5s........,所以正确的答案是C。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com