
科目: 来源:2011-2012年湖南株洲市高二上学期期末考试理科化学试卷(解析版) 题型:选择题
在密闭容器中发生如下反应:mA(g)+nB(g)
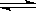 pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是
pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是
A.m+n<p B.平衡向逆反应方向移动
C.A的转化率降低 D.C的体积分数增加
查看答案和解析>>
科目: 来源:2011-2012年湖南株洲市高二上学期期末考试理科化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO42-)>c(NH4+)
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C.pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中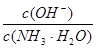 增大
增大
查看答案和解析>>
科目: 来源:2011-2012年湖南株洲市高二上学期期末考试理科化学试卷(解析版) 题型:选择题
下列方程式的书写或描述正确的是
A.用碳酸钠溶液浸泡锅炉水垢:CaSO4+CO32-
CaCO3↓+SO42-
B.热化学方程式C2H2(g)+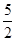 O2(g)
O2(g) 2CO2(g)+H2O(g);△H=-1256kJ/mol,表示乙炔的燃烧热为1256kJ/mol
C.铂电极电解MgCl2饱和溶液:
D.H+(aq)+OH(aq)
H2O(1);△H=-57.3 kJ/mol,表示含1 mol NaOH的氢氧化钠溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ的热量
查看答案和解析>>
科目: 来源:2011-2012年湖南株洲市高二上学期期末考试理科化学试卷(解析版) 题型:选择题
某二元弱酸H2A,在溶液中可以发生一级和二级电离:H2A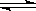 H++HA-,HA-
H++HA-,HA- H++A2-,已知相同浓度时H2A比HA-容易电离,在相同温度时下列溶液中H2A浓度最大的是
H++A2-,已知相同浓度时H2A比HA-容易电离,在相同温度时下列溶液中H2A浓度最大的是
A.0.01 mol/L的H2A溶液
B.0.01 mol/L的NaHA溶液
C.0.02 mo|/L的NaOH溶液与0.02 mol/L的NaHA溶液等体积混合
D.0.02 mol/L的HCl溶液与0.04 mol/L的NaHA溶液等体积混合
查看答案和解析>>
科目: 来源:2011-2012年湖南株洲市高二上学期期末考试理科化学试卷(解析版) 题型:选择题
用石墨电极电解100 mL H2SO4与CuSO4的混合溶液,通电一段时间后,两极均收集
到2.24 L气体(标准状况),则原混合溶液中Cu2+的物质的量浓度为
A.1mol·L-1 B.2 mol·L-1 C.3 mol·L-1 D.4 mol·L-1
查看答案和解析>>
科目: 来源:2011-2012年湖南株洲市高二上学期期末考试理科化学试卷(解析版) 题型:选择题
在25 ml 0.1 mol · L-1NaOH溶液中逐滴加入0.2mol · L-1CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是

A.在A、B间任一点(不含A、B点),溶液中可能有c (Na+) > c (CH3COO-) >c (OH-) > c (H+)
B.在B点,a>12.5,且有c (Na+) =c (CH3COO-) = c (OH-)= c (H+)
C.在C点,c (CH3COO-) > c (Na+) > c (OH-) > c (H+)
D.在D点,c (CH3COO-) +c (CH3COOH) = c (Na+)
查看答案和解析>>
科目: 来源:2011-2012年湖南株洲市高二上学期期末考试理科化学试卷(解析版) 题型:选择题
下图是一种航天器能量储存系统原理示意图。下列说法正确的是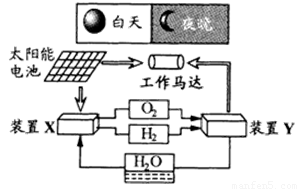
A.该系统中只存在3种形式的能量转化
B.装置Y中负极的电极反应式为:O2 + 2H2O + 4e- = 4OH-
C.装置X能实现燃料电池的燃料和氧化剂再生
D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化
查看答案和解析>>
科目: 来源:2011-2012年湖南株洲市高二上学期期末考试理科化学试卷(解析版) 题型:选择题
自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析正确的是
A.CuS的溶解度大于PbS的溶解度
B.原生铜的硫化物具有还原性,而铜蓝没有还原性
C.CuSO4与ZnS反应的离子方程式是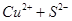
 CuS↓
CuS↓
D.整个过程涉及的反应类型有氧化还原反应和复分解反应
查看答案和解析>>
科目: 来源:2011-2012年湖南株洲市高二上学期期末考试理科化学试卷(解析版) 题型:填空题
(12 分)(每空2分)CH3COOH是中学化学中常用的一元弱酸,请回答下列问题:
(1)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸 醋酸(填“>”、“=”或“<”)。
(2)将100mL 0.1mol·L-1的CH3COOH溶液与50mL 0.2mol·L-1的NaOH溶液混合,所得溶液呈 性,原因 (用离子方程式表示)。
(3)已知某混合溶液中只含有CH3COO-、H+、Na+、OH-四种离子,且离子浓度大小关系为:c(CH3COO-)> c(H+)> c(Na+)> c(OH-),则该溶液中含有的溶质为 。
(4)已知Ka(CH3COOH)= 1.76×10-5 ,Ka(HNO2)= 4.6×10-4,若用同浓度的NaOH溶液分别中和等体积且pH相等的CH3COOH和HNO2,则消耗NaOH溶液的体积关系为:
前者 后者(填“>,<或=”)
(5)已知25℃时,0.1mol·L-1醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠呈碱性,所以溶液的pH增大;乙同学给出另外一种不同于甲同学的解释,请你写出乙同学可能的理由
查看答案和解析>>
科目: 来源:2011-2012年湖南株洲市高二上学期期末考试理科化学试卷(解析版) 题型:填空题
(16分)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上合成甲醇的反应原理为:CO(g) + 2H2(g)
 CH3OH(g) ΔH,
CH3OH(g) ΔH,
下表所列数据是该反应在不同温度下的化学平衡常数(K)。

①根据表中数据可判断ΔH 0 (填“>”、“=”或“<”)。
②在300℃时,将2 mol CO、3 mol H2和2 mol CH3OH充入容积为1L的密闭容器中,此时反应将 。
A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断
(2)已知在常温常压下:
①2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(l) ΔH = -1451.6 kJ·mol-1
②2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ·mol-1
写出该条件下甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:[来源:Zxxk.Com]
。
(3)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,则负极的电极反应式为 ,(3分)随着反应的不断进行溶液的pH (填“增大”“减小”或“不变”)。
(4)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为 一段时间后NaCl溶液的体积为1L,溶液的pH为12(25℃下测定),则理论上消耗氧气的体积为 mL(3分)(标况下)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com