
科目: 来源:2014届福建省高一下学期期中考试化学试卷(解析版) 题型:选择题
下列物质的变化过程中,化学键没有被破坏的是( )
A.食盐溶解 B.干冰升华 C.氯化铵受热 D.电解水
【解析】食盐溶于水电离出阴阳离子,破坏了离子键。干冰升华破坏的是分子间作用力。氯化铵受热分解生成氨气和氯化氢,破坏的是化学键。电解水生成氢气和氧气,破坏的水极性键。所以答案是B。
查看答案和解析>>
科目: 来源:2014届福建省高一下学期期中考试化学试卷(解析版) 题型:选择题
下列说法中错误的是( )
A.元素周期表有7个主族7个副族 B.稀有气体元素原子的最外层电子均为8
C.氢是原子半径最小的元素 D. 氧元素位于第2周期ⅥA族
【解析】稀有气体元素He的最外层只有2个电子,B是错误的,所以答案选B。
查看答案和解析>>
科目: 来源:2014届福建省高一下学期期中考试化学试卷(解析版) 题型:选择题
下列叙述中正确的是( )
A.在元素周期表中,零族元素的单质在常温下全部都是气体
B.同周期元素,ⅦA族的原子半径最大
C.ⅥA族元素的原子,其半径越大,越容易失去电子
D.所有主族元素的原子形成单原子离子时的最高化合价数都和它的族序数相等
【解析】随着相对原子质量的增大,稀有气体单质可以是液态或固体。同周期元素自左向右原子半径是增大的,所以同周期元素中第IA族的原子半径最大。同主族元素自上而下原子半径逐渐增大,原子核对外层电子的吸引力逐渐减弱,所以金属性逐渐增强,非金属性逐渐减弱。F元素没有正价,O元素没有最高化合价,所以选项D是错误的。
查看答案和解析>>
科目: 来源:2014届福建省高一下学期期中考试化学试卷(解析版) 题型:选择题
关于反应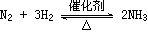 的说法错误的是( )
的说法错误的是( )
A.外界条件可以改变平衡状态 B.达到平衡时正、逆反应速率相等
C.平衡时各组分的含量也在不断变化 D.该反应所建立的平衡是动态平衡
【解析】平衡状态是在一定条件下的,当改变外界条件时,破坏将被破坏,A正确。当正逆反应速率相等时,即达到平衡状态,B正确。平衡时正逆反应速率相等,但不等于0,因此单位时间内消耗的生成的量是相同的,所以各组分的含量不再随时间变化而变化,C是错误的,D是正确的。答案选C。
查看答案和解析>>
科目: 来源:2014届福建省高一下学期期中考试化学试卷(解析版) 题型:选择题
下列各装置中,能构成原电池的是( )
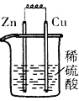



A B C D
【解析】构成原电池的条件是活泼性不同的金属或金属和非金属,导线相连且插入电解质溶液中,所以A正确。B和C中电极相同,D中没有形成完整的闭合回路。答案是A。
查看答案和解析>>
科目: 来源:2014届福建省高一下学期期中考试化学试卷(解析版) 题型:填空题
有A、B、C、D、E五种金属元素,在相同的条件下,B的最高价氧化物对应的水化物的碱性比A的最高价氧化物对应的水化物的碱性强,A、B都可以从盐溶液中置换出C;D与冷水剧烈反应并放出氢气,A、B、C、E四种金属分别投入到盐酸中,只有E不放出氢气,则这五种金属元素的金属性由强到弱的顺序为
【解析】比较金属性强弱。比较金属性强弱时可以根据最高价氧化物对应水化物的碱性强弱,或和水以及酸反应置换出氢气的难易程度,或者是根据它们之间的相互置换能力。
查看答案和解析>>
科目: 来源:2014届福建省高一下学期期中考试化学试卷(解析版) 题型:填空题
在一定条件下,向体积为2 L的容器中加入2 mol O2和3 mol SO2进行可逆反应:
2SO2(g)+ O2(g) 2SO3(g) ,2 min后测得O2的物质的量为1.6 mol,则:
2SO3(g) ,2 min后测得O2的物质的量为1.6 mol,则:
(1)2 min内,SO2的物质的量减少了 ,SO3的物质的量增加了 ;
(2)若用O2的浓度变化来表示该反应的反应速率,则V(O2)= ;
(3)若用SO3的浓度变化来表示该反应的反应速率,则V(SO3)= 。
【解析】考查可逆反应的有关计算。一般采用三段式,即
2SO2(g)+ O2(g) 2SO3(g)
2SO3(g)
起始量(mol) 3 2 0
转化量(mol) 0.8 0.4 0.8
2min后(mol) 2.4 1.6 0.8
因为反应速率通常用单位时间内浓度的变化量来表示
所以用O2的浓度变化来表示该反应的反应速率V(O2)=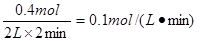
用SO3的浓度变化来表示该反应的反应速率V(SO3)=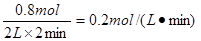
查看答案和解析>>
科目: 来源:2014届福建省高一下学期期中考试化学试卷(解析版) 题型:填空题
某化合物XY2中,各离子的电子层结构相同,且核外电子总数为54。则XY2的化学式为___________,电子式为_____________。
【解析】各离子的电子层结构相同,且核外电子总数为54,则阳离子的核外电子数为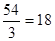 ,所以X和Y分别是Ca和Cl,即化合物是氯化钙,形成的化学键是离子化合物,所以电子式为
,所以X和Y分别是Ca和Cl,即化合物是氯化钙,形成的化学键是离子化合物,所以电子式为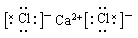 。
。
查看答案和解析>>
科目: 来源:2014届福建省高一下学期期中考试化学试卷(解析版) 题型:填空题
有 A、B、C三种短周期元素。A-离子的电子层结构和氖原子相同;短周期元素中B的金属性最强;C的原子核内质子数是B的次外层电子数的2倍。试推断:
⑴.这三种元素分别是:A______、B______、C______;(用元素符号表示)
⑵. A的氢化物分子的电子式是__________;
⑶.C元素的最高价氧化物与足量NaOH溶液反应的离子方程式为___________。
【解析】考查原子核外电子的排布规律。A-离子的电子层结构和氖原子相同,所以A是F。短周期元素中金属性最强的是钠,则B是Na。 C的原子核内质子数是B的次外层电子数的2倍,所以C是S。HF形成的化学键是极性键,其电子式为 。
。
查看答案和解析>>
科目: 来源:2014届福建省高一下学期期中考试化学试卷(解析版) 题型:填空题
已知X、Y、Z都是短周期的元素,它们的原子序数依次递增。X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y和Z可以形成两种以上气态化合物,则
(1)X是 、Y是 、Z是 。
(2)由Y和Z组成,且Y和Z质量比为7∶20的化合物的化学式(分子式)是 。
(3)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子的个数比为4∶2∶3,该盐的化学式(分子式)是 。
【解析】考查原子核外电子的排布规律。原子的电子层数与它的核外电子总数相同的只有氢元素,即X是H。Z原子的最外层电子数是次外层电子数的三倍,则Y是O。原子序数小于8,且与O能形成两种以上气态化合物的应是N元素,即Y是N。N和O的质量之比是7∶20,则N和O的原子个数之比是 ,所以化合物是N2O5。H、N、O的原子个数比为4∶2∶3,则该化合物为硝酸铵。
,所以化合物是N2O5。H、N、O的原子个数比为4∶2∶3,则该化合物为硝酸铵。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com