
科目: 来源:2013届浙江省高二下学期期中考试化学试卷(解析版) 题型:选择题
在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100 mol·L-1,c(B)=0.200 mol·L-1,
c(C)=0 mol·L-1。反应物A的浓度随时间的变化如图所示。下列说法正确的是
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100 mol·L-1,c(B)=0.200 mol·L-1,
c(C)=0 mol·L-1。反应物A的浓度随时间的变化如图所示。下列说法正确的是

A.若反应①、②的平衡常数分别为K1、K2,则K1< K2
B.反应A+2B C的△H>0
C的△H>0
C.实验②平衡时B的转化率为60%
D.减小反应③的压强,可以使平衡时c(A)=0.060 mol·L-1
查看答案和解析>>
科目: 来源:2013届浙江省高二下学期期中考试化学试卷(解析版) 题型:选择题
工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为CH2==CH2(g)+H2O(g) CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等。下图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是
CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等。下图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是

A.合成乙醇的反应一定为吸热反应
B.目前工业上采用250~300 ℃,主要是因为在此温度下乙烯的转化率最大
C.目前工业上采用加压条件(7 MPa左右),目的是提高乙醇的产率和加快反应速率
D.只要给予该反应足够的压强,就可以实现转化率100%
查看答案和解析>>
科目: 来源:2013届浙江省高二下学期期中考试化学试卷(解析版) 题型:选择题
在25℃下,取0.2 mol·L-1 HX溶液与0.2 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则下列说法(或关系式)正确的是
A.混合溶液中水电离出的c(OH-)小于0.2 mol·L-1 HX溶液中水电离出的c(H+)
B.c(Na+)=c(X-) +c(HX)=0.2 mol·L-1
C.c(Na+)-c(X-)=9.9×10-7 mol·L-1
D.c(OH-)=c(HX)+c(H+)=1×10-8 mol·L-1
查看答案和解析>>
科目: 来源:2013届浙江省高二下学期期中考试化学试卷(解析版) 题型:选择题
向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体后,可以得到不同的成分组合,其中混合组分的物质的量为1:1 请选择下列分析都正确的组合是:
|
|
溶液组成主要成分 |
溶液中离子浓度关系 |
|
A |
NaHCO3、Na2CO3 |
c(CO32-) < c(HCO3-) |
|
B |
NaOH 、 Na2CO3 |
c(OH-)<c(CO32-) |
|
C |
Na2CO3 |
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
|
D |
NaHCO3、NaOH |
c(Na+) = c(HCO3-) |
查看答案和解析>>
科目: 来源:2013届浙江省高二下学期期中考试化学试卷(解析版) 题型:填空题
(14分)完成下列各题:(1).在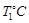 时,向容积为2L的密闭容器甲中加入1molN2、3molH2及少量固体催化剂,发生反应N2(g)+3H2(g)
时,向容积为2L的密闭容器甲中加入1molN2、3molH2及少量固体催化剂,发生反应N2(g)+3H2(g) 2NH3(g);
2NH3(g); ,10min时各物质的浓度不再变化,测得NH3的物质的量为0.4mol。
,10min时各物质的浓度不再变化,测得NH3的物质的量为0.4mol。
①该反应在0~10min时间内H2的平均反应速率为 N2的转化率为
②在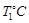 时,若起始时在容器甲中加入0.5molN2、1.5 molH2、1 molNH3,则达到平衡时NH3的物质的量为( )(填选项字母)
时,若起始时在容器甲中加入0.5molN2、1.5 molH2、1 molNH3,则达到平衡时NH3的物质的量为( )(填选项字母)
a 大于0.4mol b 等于0.4mol c 小于0.4mol
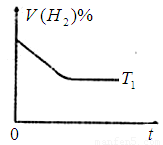
③下图是在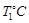 时密闭容器甲中H2的体积分数随时间t的变化曲线,请在该图中补画出该反应在
时密闭容器甲中H2的体积分数随时间t的变化曲线,请在该图中补画出该反应在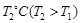 时的H2体积分数随时间t的变化曲线。
时的H2体积分数随时间t的变化曲线。
(2).已知:Al3 +与HCO3–、CO32–、HS-、S2-等能发生彻底的
双水解,生活中通常利用Al3 +与HCO3–的反应来制作泡沫灭火器。泡沫灭火器的简易构造如下图,a为玻璃瓶,b为铁筒,请思考:

①参与反应的液体分别为Al2(SO4)3和NaHCO3,请问a瓶中盛放的液体为: 。
②为了保证泡沫灭火器的使用寿命,通常在Al2(SO4)3溶液中加入另一种物质抑制硫酸铝的水解,请问该物质是 。
③已知苯酚是比碳酸更弱的酸,请问,苯酚钠和硫酸铝能否发生彻底的双水解?如能,请写出该反应的离子反应方程式: 。
查看答案和解析>>
科目: 来源:2013届浙江省高二下学期期中考试化学试卷(解析版) 题型:填空题
(8分)已知25℃时几种物质的电离度(溶液浓度均为0.1mol/L) 如下表(已知硫酸的第一步电离是完全的):
|
①硫酸溶液 |
②硫酸氢钠溶液 |
③醋酸溶液 |
④盐酸 |
|
HSO4- |
HSO4- |
CH3COOH |
HCl = H++Cl- |
|
10℅ |
29℅ |
1.33℅ |
100℅ |
⑴根据题意,请写出向硫酸溶液中滴加足量氢氧化钡溶液反应的离子反应方程式
⑵25℃时,0.1mol/L上述几种溶液中C(H+)由大到小的顺序是 (填序号,下同);
⑶25℃时,将足量锌粉放入等体积pH=1的上述几种溶液中,产生H2的体积(相同状况)由大到小的顺序是 ;
⑷25℃时,0.1mol/L H2SO4中的HSO4-的电离度小于0.1mol/L NaHSO4中HSO4-的电离度的原因是:
查看答案和解析>>
科目: 来源:2013届浙江省高二下学期期中考试化学试卷(解析版) 题型:填空题
(8分)在温度T1和T2下,X2(g)和 H2反应生成HX的平衡常数如下表:
|
化学方程式 |
K (T1 ) |
K (T2) |
|
F2+H2 |
1.8 ×1036 |
1.9 ×1032 |
|
Cl2+H2 |
9.7 ×1012 |
4.2 ×1011 |
|
Br2+H2 |
5.6 ×107 |
9.3 ×106 |
|
I2+H2 |
43 |
34 |
(1)仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,_______(选填字母)
a.在相同条件下,X2的平衡转化率逐渐降低 b. X2与H2反应的剧烈程度逐渐减弱
c. HX的稳定性逐渐减弱 d. HX的还原性逐渐减弱
(2)在容积为3L的密闭容器中,由I2(g)和H2(g)合成HI(g),在其他条件不变的情况下,研究温度对反应的影响,HI的物质的量的变化情况如下图所示。

①温度为T1时,在0~tAmin内,H2的消耗速率v (H2)=__________
②分析右图所示图像,下列说法正确的是________(填序号)
a.温度为T2,容器内气体密度不变时,反应到达B点所示状态
b.平衡状态从A点移动到B点,n(HI)/n(H2)增大
c.该反应为放热反应
(3)加水稀释0.1mol·L-1的HF溶液,下列各量中增大的是________(填序号)
a.c(H+) b. Ka(HF) c. c(F-)/c(H+) d. c(H+) / c(HF)
查看答案和解析>>
科目: 来源:2013届浙江省高二下学期期中考试化学试卷(解析版) 题型:填空题
(10分)食醋分为酿造醋和配制醋两种。国家标准规定酿造食醋总酸含量不得低于3.5g/100mL。
(1)某研究小组利用滴定分析法测定某品牌食醋中醋酸的含量,下列说法正确的是 。
a.用NaOH溶液滴定时反应的离子方程式为:H++OH-=H2O
b.食醋试样需稀释一定倍数后再进行滴定
c.用NaOH溶液滴定食醋,可使用酚酞或甲基橙作指示剂
d.若测得该品牌食醋的物质的量浓度为0.75mol·L-1,则该食醋的总酸量为4.5g/100mL。
(2)研究小组的同学仔细观察了该品牌食醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与食品添加剂(苯甲酸钠C6H5COONa)不会发生离子互换反应,需查找在一定温度下的醋酸与苯甲酸的 (填写序号)。
a.pH b.电离度 c.电离常数 d.溶解度
(3)常温下,用0.1000 mol·L-1NaOH溶液分别滴定20.00mL 0.1000 mol·L-1HCl溶液和20.00mL 0.1000 mol·L-1CH3COOH溶液,得到2条滴定曲线,如下图所示。
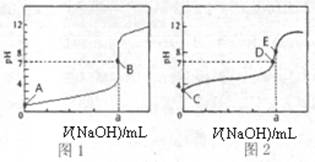
①滴定醋酸溶液的曲线是 (填“图l”或“图2”);滴定曲线中a= mL;
②E点pH>8的原因用离子方程式表示 。
(4)现欲粗略测定一未知浓度的CH3COOH溶液的电离度,应做的实验和所需的试剂(试纸)是 。
a.电解,NaOH溶液 b.蒸馏,Na2CO3溶液
c.酯化反应,石蕊试液 d.中和滴定,pH试纸
查看答案和解析>>
科目: 来源:2013届浙江省高二下学期期中考试化学试卷(解析版) 题型:计算题
如图所示,当关闭阀门K时,向甲中充入1.5 mol A、3.5 mol B,向乙中充入3 mol A、7 mol B,起始时,甲、乙体积均为V
L。在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:3A(g)+2B(g)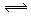 C(g)+2D(g) ΔH<0;达到平衡(Ⅰ)时,V(乙)=0.86V L。请回答:
C(g)+2D(g) ΔH<0;达到平衡(Ⅰ)时,V(乙)=0.86V L。请回答:
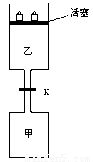
(1)乙中B的转化率为
(2)甲中D和乙中C的物质的量比较: (填“相等”、“前者大”、“后者大”);
(3)打开K,过一段时间重新达平衡(Ⅱ)时,乙的体积为 (用含V的代数式表示,连通管中气体体积忽略不计。)
查看答案和解析>>
科目: 来源:2013届湖北长阳土家自治县一中高二下学期期中化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.植物油和矿物油都是酯,都可以作为有机溶剂
B.“酒是陈年香”是因为酒的保存过程中有酯生成
C.人的三大营养物质是糖、蛋白质与油脂,前两种是高分子化合物
D.蛋白质的盐析是可逆的,可用于精制蛋白质。所以,动物食用NaCl是不会中毒的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com