
科目: 来源:2014届浙江省高一下学期期中检测化学试卷(解析版) 题型:选择题
下列各组热化学方程式中,△H1>△H2的是
①C(s)+O2(g)=CO2(g) △H1 C(s)+O2(g)=CO(g) △H2
②S(s)+O2(g)=SO2(g) △H1 S(g)+O2(g)=SO2(g) △H2
③H2(g)+O2(g)=H2O(l) △H1 2H2(g)+O2(g)=2H2O(l) △H2
④CaCO3(s)=CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)=Ca(OH)2(s) △H2
A.① B.④ C.②③④ D.①②③
查看答案和解析>>
科目: 来源:2014届浙江省高一下学期期中检测化学试卷(解析版) 题型:选择题
铊(Tl)是某超导材料的组成元素之一,与铝同族,位于第六周期。
Tl3+与Ag在酸性介质中发生反应:Tl3+ + 2Ag = Tl+ + 2Ag+ 下列推断正确的是:
A.Tl+的最外电子层有1个电子 B.Tl3+的氧化性比Ag+弱
C.Tl能形成+3价和+1价的化合物 D.Tl+的还原性比Ag强
查看答案和解析>>
科目: 来源:2014届浙江省高一下学期期中检测化学试卷(解析版) 题型:选择题
共价键、离子键和分子间作用力是微粒之间的三种作用力,
下列晶体①Ba(OH)2 ②SiO2 ③石墨 ④KCl ⑤干冰中,含有两种作用力的是
A. ①②③ B. ①③⑤ C. ②④⑤ D. ②③④
查看答案和解析>>
科目: 来源:2014届浙江省高一下学期期中检测化学试卷(解析版) 题型:选择题
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验中,不考虑两球的浮力变化)
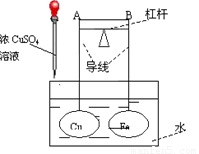
A.杠杆为导体或绝缘体时,均为A端高B端低
B.杠杆为导体或绝缘体时,均为A端低B端高
C.当杠杆为导体时,A端低B端高;杠杆为绝缘体时,A端高B端低
D.当杠杆为导体时,A端高B端低;杠杆为绝缘体时,A端低B端高
查看答案和解析>>
科目: 来源:2014届浙江省高一下学期期中检测化学试卷(解析版) 题型:选择题
观察下图,下列说法正确的是
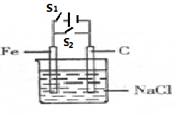
A. 断开S1,闭合S2,C电极上发生的反应为O2+4e-+4H+=2H2O
B. 断开S1,闭合S2,Fe电极作原电池的负极,发生还原反应。
C. 闭合S1,断开S2,溶液中的Cl- 向C电极方向移动。
D. 闭合S1,断开S2,阳极本身失电子,被氧化。
查看答案和解析>>
科目: 来源:2014届浙江省高一下学期期中检测化学试卷(解析版) 题型:填空题
(6分)下列物质中:
(1)互为同分异构体的有 (2)互为同素异形体的有
(3)属于同位素的有 (填序号)
①液氯 ②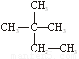 ③白磷 ④氯气 ⑤
③白磷 ④氯气 ⑤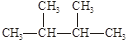
⑥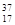 Cl ⑦
Cl ⑦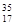 Cl ⑧红磷
Cl ⑧红磷
查看答案和解析>>
科目: 来源:2014届浙江省高一下学期期中检测化学试卷(解析版) 题型:填空题
(16分)W、M、X、Y、Z、Q是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色。六种元素核电荷数之和为71,W、Q最外层电子数相同,Q的核电荷数是W的2倍。Z的单质和氧化物均为原子晶体。工业上一般通过电解氧化物的方法获得Y的单质。请回答下列问题:
(1)Y的离子结构示意图_____________;M元素在元素周期表中的位置为_______________。
(2)写出电子式并在括号内指出所含化学键的类型:W的单质_____________( );
X与W按原子个数比2:1形成的化合物 _____________( ).
(3)W、M、X、Y、Z、Q原子半径由小到大的顺序为_____________________(用元素符号表示)。
(4)W、M、Q形成的氢化物的稳定性__________________________(用氢化物分子式表示)
Z元素氢化物的分子空间构型___________________。
(5)X、Y、Q的最高价氧化物对应的水化物之间两两均可反应,写出反应的离子方程式,
________________________,________________________,______________________;
(6)写出一个化学反应方程式,证明下列结论:
非金属性M比W强:__________________________________________________________;
非金属性Q比Z强:______________________________________________________________。
查看答案和解析>>
科目: 来源:2014届浙江省高一下学期期中检测化学试卷(解析版) 题型:填空题
(14分)我国是世界上最大的耗煤国家,但每年占总产量70%的煤都被直接烧掉,既浪费了资源又污染环境。因此开发新能源是国家能源发展的方向。
试回答下列问题:
(1)已知1.12LCH4(标况)完全燃烧生成二氧化碳和液态水,可放出44.5KJ的热量,则其热化学方程式为__________;
(2)人们常用“热值”来衡量燃料燃烧放出的热量的大小。“热值”是指常温常压下,1g物质完全燃烧生成稳定物质放出的热量。则CH4的热值是________KJ.g-1
(3)氢气是一种清洁能源,它不仅热值高,而且原料丰富。氢氧燃料电池是以氢气为燃料,氧气是氧化剂,以氢氧化钾为电解质溶液的燃料电池,试写出正、负极的电极反应式:
正极_______________________ ,负极________________________________.
(4)若以上述氢氧燃料电池作电源,以碳棒为阳极电解100mL饱和食盐水,则阳极的电极反应式为__________________________;当电路中通过0.2mol电子时,阳极可产生的气体____________L(标况下),此时溶液中氢氧化钠的物质的量浓度为________mol.L-1(假设电解前后溶液体积不变).
查看答案和解析>>
科目: 来源:2014届浙江省高一下学期期中检测化学试卷(解析版) 题型:实验题
(8分)用纯净的块状的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:

(1)实验过程如右图所示,分析判断:______段化学反应速率最快,_______段收集的二氧化碳气体最多。
(2)上述反应中,A g块状碳酸钙跟足量盐酸反应,反应物消耗的质量随时间的变化曲线由实线表示,在相同的条件下,将B g (A>B)粉末状碳酸钙与足量的同浓度盐酸反应,反应物消耗的质量随时间的变化曲线由虚线表示。则最符合实际情况的图像是________
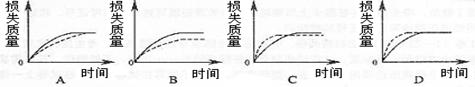
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是_________.
A.蒸馏水 B.氯化钠 C.硝酸钾溶液 D.浓盐酸 E.降温 F加入MnO2
查看答案和解析>>
科目: 来源:2014届浙江省高一下学期期中检测化学试卷(解析版) 题型:填空题
(10分)一定的温度下向2L密闭容器中通入2molSO2和2molO2,发生反
应: 2SO2+O2 2SO3.5min后达到平衡,测得容器中有SO31.6mol.
2SO3.5min后达到平衡,测得容器中有SO31.6mol.
回答下列问题:
(1) 反应5min内,v(O2)=_________mol.L-1.min-1.
(2) 化学反应达到平衡时,SO2消耗的浓度占起始浓度的百分比为__________;此时,容器中c(O2)=_______,压强是起始时的_______倍.
(3) 判断该反应达到平衡的标志是_______________;
A.v消耗(SO2)=v生成(SO3) B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变 D.容器中气体的总物质的量不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com