
科目: 来源:2013届江苏省高二下学期期中考试化学试卷(解析版) 题型:选择题
用惰性电极电解一定浓度的硫酸铜溶液,通电一定时间后,向所得溶液中加入0.1molCu2(OH)2CO3后恰好恢复到电解前的浓度和pH(不考虑二氧化碳的溶解)。则电解过程中共转移电子数为
A.0.4mol B.0.5mol C.0.6mol D.0.8mol
查看答案和解析>>
科目: 来源:2013届江苏省高二下学期期中考试化学试卷(解析版) 题型:选择题
常温下甲、乙两醋酸溶液,测得甲的pH= a,乙的pH= a+1。下列推断中正确的是
A.甲中由水电离产生的H+的物质的量浓度是乙的0.1倍
B.物质的量浓度c(甲)=10c(乙)
C.中和等物质的量的NaOH溶液,需甲、乙两酸的体积V(乙)>10V(甲)
D.甲中的c(OH-)为乙中的c(OH-)的10倍
查看答案和解析>>
科目: 来源:2013届江苏省高二下学期期中考试化学试卷(解析版) 题型:选择题
已知可逆反应X(g)+Y(g)  Z(g) (未配平)。温度为T0时,在容积固定的容器中发生反应各物质的浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是
Z(g) (未配平)。温度为T0时,在容积固定的容器中发生反应各物质的浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是

A.图a中,各物质的反应速率大小关系为:v(X)= v(Y)= 2v(Z)
B.T0时,该反应的平衡常数为0.03
C.图a中反应达到平衡时,X、Y的转化率相同
D.T1时的平衡常数大于T2时的平衡常数,但小于33.3
查看答案和解析>>
科目: 来源:2013届江苏省高二下学期期中考试化学试卷(解析版) 题型:选择题
在恒温恒容的密闭容器中,发生反应3A(g)+B(g)  xC(g)。Ⅰ、将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a;Ⅱ、若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。下列说法正确的是
xC(g)。Ⅰ、将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a;Ⅱ、若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。下列说法正确的是
A.若Ⅰ达平衡时,A、B、C各增加1mol,则B的转化率将一定增大
B.若Ⅱ体系起始物质的量当满足3 n(C) +8n(A)=12 n(B)时,可判断x=4
C.若x=2,则Ⅱ体系起始物质的量应当满足3 n(B) =n(A)+3
D.若向Ⅰ平衡体系中再加入3molA和2molB,C的体积分数若大于a,可断定x>4
查看答案和解析>>
科目: 来源:2013届江苏省高二下学期期中考试化学试卷(解析版) 题型:填空题
(14分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a ;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
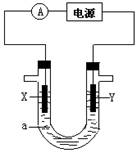
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,电解开始后,在X极附近观察到溶液变红色,则X极与电源的____极连接,电解时X极上的电极反应为 ;检验Y电极上反应产物的方法是 : ,电解过程中的总电解反应式为 。
(2)如果用该装置精炼铜,选用CuSO4作电解质溶液,则连接粗铜的是_______极(填写“X”或“Y”),析出Cu的一极的
电极反应式是 ,反应后,电解质溶液CuSO4的浓度___(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目: 来源:2013届江苏省高二下学期期中考试化学试卷(解析版) 题型:填空题
(12分)(1)常温下,水的离子积KW=__________,则一滴水中(约20滴水为1mL)所含的H+数目为_________个
(2)测得80℃时,纯水中c(H+)=2×10—7,则80℃时浓度为0.2 mol·L-1的Ba(OH)2溶液的pH=______。此温度下将此溶液a L与pH=1的H2SO4溶液b L混合:
①若所得混合液为中性,则a∶b= ;
②若所得混合液的pH=12,则a∶b= ;
③为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,定义AG= 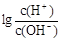 ,则80℃时,该Ba(OH)2溶液的酸度AG=______________。(结果保留对数形式)
,则80℃时,该Ba(OH)2溶液的酸度AG=______________。(结果保留对数形式)
查看答案和解析>>
科目: 来源:2013届江苏省高二下学期期中考试化学试卷(解析版) 题型:实验题
(16分)某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:①量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液。
②用标准液滴定至终点,记录滴定管液面读数,所得数据如下表:
|
滴定次数 |
盐酸体积 |
NaOH溶液体积读数(mL) |
|
|
滴定前 |
滴定后 |
||
|
1 |
20.00 |
0.00 |
18.10 |
|
2 |
20.00 |
0.00 |
16.30 |
|
3 |
20.00 |
0.00 |
16.22 |
请回答下列问题:
(1)步骤①中,量取20.00mL待测液应使用 (填仪器名称),若在锥形瓶装液前残留少量蒸馏水,将使测定结果__________(填“偏大”、“偏小”或“无影响”)。
(2)判断到达滴定终点的现象是___________________________________________。
(3)第一次滴定记录的NaOH溶液的体积明显多于后两次的体积,其可能的原因是___________________(填字母)
A.滴定前滴定管尖嘴有气泡,滴定结束时无气泡
B.锥形瓶装液前用待测液润洗
C.NaOH标准液保存时间过长,有部分Na2CO3生成
D.滴定终点时,俯视读数
(4)由以上数据,该盐酸的物质的量浓度为 ,若要计算盐酸溶液中盐酸的质量分数还缺少的物理量是: ;(请注明单位)。如缺少的数据用字母a表示,则盐酸溶液中盐酸的质量分数为 ;
(5)下列操作会使结果偏高的是 (多选倒扣分)
A.碱式滴定管用蒸馏水洗净后,即注入标准NaOH溶液
B.用酸式滴定管取用待测酸液前,尖嘴部分有气泡,取用过程中气泡消失
C.滴定前,读碱液体积时仰视;滴定后,读碱液体积时俯视
D.滴定前,盛放盐酸的锥形瓶不干燥
查看答案和解析>>
科目: 来源:2013届江苏省高二下学期期中考试化学试卷(解析版) 题型:填空题
(8分)甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料。
已知:CH3OH(1) + O2(g) = CO(g) + 2H2O(g) △H = -443.64 kJ·mol-1
2CO (g) + O2(g) = 2CO2(g) △H =-566.0 kJ·mol-1
(1)试写出2molCH3OH(1)在氧气中完全燃烧生成CO2和H2O(g)的热化学方程式:
(2)科研人员新近开发出一种由甲醇和氧气以强碱做电解质溶液的新型手机电池,可使手机连续使用一个月才充一次电,据此回答下列问题:
甲醇在 极反应;O2一极发生的电极反应方程式为
(3)若用该电池在某金属表面镀铜,若待镀金属的质量增加了6.4g,则至少消耗甲醇的质量为 g。
查看答案和解析>>
科目: 来源:2013届江苏省高二下学期期中考试化学试卷(解析版) 题型:填空题
(16分)在一个固定体积的密闭容器中发生某反应,当改变其他反应条件,在I、II、III阶段,体系中各物质浓度随时间变化的曲线如下图所示:
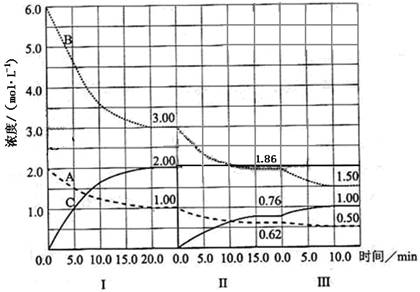
(1)该反应的化学方程式为 (物质用图中的“A”、“B”、“C”表示),该反应在第I阶段的平衡常数为 。
(2)第III阶段,从开始至平衡,用B表示的平均反应速率为 ;
(3)第I阶段,A的转化率为 ;第III阶段达平衡后,C的体积分数为 ;
(4)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 ;
(5)已知第Ⅱ阶段反应温度(T2)低于第III阶段反应温度(T3),则该反应的正反应
△H 0(填“<”或“>”)
查看答案和解析>>
科目: 来源:2014届江苏省高一下学期期中考试化学试卷(解析版) 题型:选择题
生物质能是绿色植物通过叶绿素将太阳能固化为化学能而贮存在生物质内部的能量。江苏是全国以试验性利用生物质能最多的省份。下列说法不正确的是
A.在生物质能产业,“地沟油”是生物柴油的重要原料之一
B.生物质能具有可再生性、低污染性、广泛分布性等特点
C.生物质能资源包括:森林能源、农作物秸秆、禽畜粪便、生活垃圾
D.“生物柴油”与“柴油”的化学成分相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com