
科目: 来源:2012届安徽省高二下学期第二次月考化学试卷(解析版) 题型:选择题
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g)  2NH3(g) △H <0,在673K、30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是 ( )
2NH3(g) △H <0,在673K、30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是 ( )
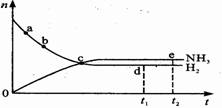
A、点 c处反应达到平衡
B、点a的正反应速率比点b的大
C、点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样
D、其他条件不变,773K下反应至t1时刻,n(H2)比图中d点的值小。
【解析】c点之后物质的量是变化的,所以c点没有达到平衡状态,A不正确。A点反应物的浓度减小,生成物的浓度增加,所以a点正反应速率大于逆反应速率,B正确。d和e均是相同条件下的平衡状态,所以氮气的物质的量是相同的,C不正确。因为反应是放热反应,所以温度升高,平衡向逆反应方向移动,氢气的物质的量是增加的,因此D也是错误的。答案选B。
查看答案和解析>>
科目: 来源:2012届安徽省高二下学期第二次月考化学试卷(解析版) 题型:选择题
在氯化铵溶液中,下列关系式正确的是 ( )
A、c(Cl—)>c(NH4+)>c(H+)>c(OH—) B、c(NH4+)>c(Cl—)>c(H+)>c(OH—)
C、c(Cl—)=c(NH4+)>c(H+)=c(OH—) D、c(NH4+)=c(Cl—)>c(H+)>c(OH—)
【解析】在氯化铵溶液中,由于NH4+水解,溶液显酸性。但因为水解程度很弱,大部分NH4+是不水解的,所以正确的答案是A。
查看答案和解析>>
科目: 来源:2012届安徽省高二下学期第二次月考化学试卷(解析版) 题型:选择题
将0.1 mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体,都会引起 ( )
A、溶液的pH增加 B、CH3COOH电离程度变大
C、溶液的导电能力减弱 D、溶液中c(OH—)减小
【解析】醋酸是若电解质,在溶液中存在电离平衡CH3COOH CH3COO-+H+,吸收促进电离,但溶液的酸性会降低,即pH是增大的。若加入少量醋酸钠晶体,则会增大醋酸根的浓度,抑制醋酸的电离,即pH也是增大的,但溶液的导电性是增强的,所以正确的答案是A。
CH3COO-+H+,吸收促进电离,但溶液的酸性会降低,即pH是增大的。若加入少量醋酸钠晶体,则会增大醋酸根的浓度,抑制醋酸的电离,即pH也是增大的,但溶液的导电性是增强的,所以正确的答案是A。
查看答案和解析>>
科目: 来源:2012届安徽省高二下学期第二次月考化学试卷(解析版) 题型:选择题
在恒温、恒容下,发生如下反应:2A(g)+2B(g) 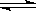 C(g)+3D(g),现从两条途径分别建立平衡,途径Ⅰ:A、B的起始浓度均为2 mol·L—1途径Ⅱ: C、D的起始浓度分别为2 mol·L—1 和6 mol·L—1 ,以下叙述正确的是 (
)
C(g)+3D(g),现从两条途径分别建立平衡,途径Ⅰ:A、B的起始浓度均为2 mol·L—1途径Ⅱ: C、D的起始浓度分别为2 mol·L—1 和6 mol·L—1 ,以下叙述正确的是 (
)
A、达到平衡时,途径I的反应速率等于途径Ⅱ的反应速率
B、达到平衡时,途径I所得混合气体的压强等于途径Ⅱ所得混合气体的压强
C、两途径最终达到平衡时,体系内各组分的百分含量相同
D、两途径最终达到平衡时,体系内各组分的百分含量不相同
【解析】因为平衡的建立和途径是无关的,所以途径Ⅱ中相当于是A、B的浓度都是4mol/L,容器容积相同,所以途径Ⅱ中压强大,反应快,A不正确。由于反应前后体积不变,所以在反应过程中压强是不变的,即途径Ⅱ所得混合气体的压强是途径I所得混合气体的压强的2倍,B不正确。反应前后体积不变,而起始A和B的浓度之比都是1︰1的,所以在这2种条件下所得到的平衡状态是等效的,因此C正确,D错误。答案是C。
查看答案和解析>>
科目: 来源:2012届安徽省高二下学期第二次月考化学试卷(解析版) 题型:选择题
25℃ 时,向1 mL pH=1的硫酸中滴加的10 mL pH= b的NaOH溶液,形成的混合溶液成碱性则b可能为 ( )
A、10 B 、11 C、12 D、13
【解析】混合后溶液显碱性,说明氢氧化钠是过量的,即0.001L×0.1mol/L<0.01L×10(b-14),解得b>12,所以只有选项D是正确的。
查看答案和解析>>
科目: 来源:2012届安徽省高二下学期第二次月考化学试卷(解析版) 题型:选择题
可以充分说明反应 P(g)+Q(g)⇋ R(g)+S(g)在恒温下已达到平衡的是 ( )
A、反应容器内的压强不随时间改变
B、反应容器内P、Q、R、S四者共存
C、P的生成速率和S的生成速率相等
D、反应容器内的气体总物质的量不随时间变化
【解析】因为反应前后气体的体积不变,所以气体的总物质的量就始终不变,同样压强也就始终不变,所以A、D不能说明。可逆反应的特点就是反应物和生成物同时存在,B不一定能说明。选项C中的反应速率方向相反,且满足速率之比是相应的化学计量数之比,所以可以说明已经达到平衡状态。答案是C。
查看答案和解析>>
科目: 来源:2012届安徽省高二下学期第二次月考化学试卷(解析版) 题型:选择题
现有等浓度的下列溶液:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤碳酸钠,⑥碳酸氢钠.按溶液pH由小到大排列正确的是 ( )
A、④①②⑤⑥③ B、④①②⑥⑤③ C、①④②⑥③⑤ D、①④②③⑥⑤
【解析】酸越弱,相应的盐就越容易水解,碱性就越强,pH就越大。酸性强弱顺序为醋酸>碳酸>苯酚>碳酸氢钠,所以溶液pH由小到大排列是醋酸<碳酸<苯酚<碳酸氢钠<苯酚钠<碳酸钠,即选项C正确。答案是C。
查看答案和解析>>
科目: 来源:2012届安徽省高二下学期第二次月考化学试卷(解析版) 题型:选择题
氢氧化钠标准溶液因保存不当,吸收了少量的二氧化碳。若有1%的NaOH转变为 Na2CO3,以此NaOH溶液滴定未知浓度的盐酸,选用甲基橙作指示剂,盐酸浓度的测定结果会( )。
A、偏低l% B、偏高1% C、无影响 D、偏高0.1%
【解析】因为不论是氢氧化钠还是碳酸钠和盐酸反应的最终产物都是氯化钠,虽然碳酸钠还生成二氧化碳,但由于甲基橙的变色范围是3.1~4.4,所以根据钠离子守恒可知,消耗的盐酸是相同的,因此对测定结果是无影响的。答案选C
查看答案和解析>>
科目: 来源:2012届安徽省高二下学期第二次月考化学试卷(解析版) 题型:实验题
(13分)某学生为测定未知浓度的硫酸溶液,实验如下:用I.00mL待测硫酸配制100mL稀H2S04溶液;以0.14mol/L的NaOH溶液滴定上述稀H2S04 25mL,滴定终止时消耗NaOH溶液15mL。
(1)该学生用标准o.14mol/L的NaOH溶液滴定硫酸的实验操作如下:
A、用酸式滴定管取稀H2S04 25mL,注入锥形瓶中,加入指示剂;
B、用待测定的溶液润洗酸式滴定管;
C、用蒸馏水洗干净滴定管;
D、取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上1~2cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下;
E、检查滴定管是否漏水;
F、另取锥形瓶,再重复操作一次;
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是 (用序号填写)
②该滴定操作中应选用的指示剂是 。
③在G操作中如何确定终点? 。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果 (填“偏小”“偏大”或“恰好合适”),原因是 。
(3)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度为 mol/L(结果保留两位小数点)。
【解析】考查中和滴定实验操作及误差分析。滴定管在使用前需要查漏,然后用蒸馏水洗涤,最后用标准液润洗。硫酸和氢氧化钠恰好反应时,溶液显中性,所以应选择酚酞作指示剂。当反应达到滴定终点时,溶液将变成红色。若碱式滴定管未用标准液润洗,则相当于稀释了氢氧化钠溶液,从而导致消耗氢氧化钠溶液的体积偏大,测定结果偏大。根据题意可知消耗氢氧化钠的物质的量是0.14mol/L×0.015L=0.0021mol,所以需要硫酸的物质的量是0.00105mol,因此硫酸的浓度是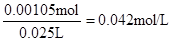 ,所以稀释前硫酸的浓度为0.042mol/L×100=4.2mol/L。
,所以稀释前硫酸的浓度为0.042mol/L×100=4.2mol/L。
查看答案和解析>>
科目: 来源:2012届安徽省高二下学期第二次月考化学试卷(解析版) 题型:填空题
(9分)pH=12的NaOH溶液100ml,要使它的pH为11。(体积变化忽略不计)
(1)如果加入蒸馏水,应加 mL。
(2)如果加入pH=10的NaOH溶液,就加 mL。
(3)如果加0.01mol/L的HC1,应加 mL。
【解析】考查pH的计算。
(1)若加水稀释。强碱每稀释10n倍,强碱的pH就减小n个单位,pH由12变为11,则相当于稀释10倍,及最终溶液的体积是1000ml,所以需要水1000ml-100ml=900ml。
(2)若加入强碱。PH=11,则混合后OH-的物质的量浓度为0.001mol/L。所以有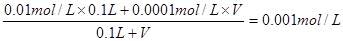 ,解得V=1L.
,解得V=1L.
(3)若加入盐酸,则发生中和反应。因此 ,解得V=0.0818L。
,解得V=0.0818L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com