
科目: 来源:2012届安徽省高二下学期第二次月考化学试卷(解析版) 题型:选择题
下列说法中正确的是 ( )
A、某反应在低温条件下能自发进行,那么该反应在高温条件下也一定能自发进行
B、某反应在高温条件下不能自发进行,那么该反应在低温条件下也一定不能自发进行
C、反应方向是由焓变和熵变共同决定的,与反应温度无关
D、温度有可能对反应的方向起决定性作用
【解析】考查化学反应进行的方向。反应能否自发进行,主要由焓变和熵变共同决定,即只有当△G=△H-T·△S<0时反应才是自发进行的因此低温下能自发进行的反应,高温下就不一定能自发进行,A不正确。同理分析选项B也是错误的。关系式△G=△H-T·△S可知,反应方向是和温度有关系的,C不正确,D正确。答案选D。
查看答案和解析>>
科目: 来源:2012届安徽省高二下学期第二次月考化学试卷(解析版) 题型:选择题
符合如图所示的热化学方程式是 ( )
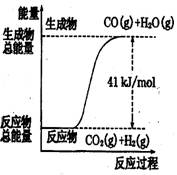
A、CO+H2O=CO2+H2;△H=+41 kJ/mol
B、CO(g)+H2O(g)=CO2(g)+H2(g);;△H= −41 kJ/mol
C、CO2(g)+H2(g)=CO(g)+H2O(g);△H=+41 kJ/mol
D、CO2(g)+H2(g) =CO(g)+H2O(g);△H=−41 kJ/mol
【解析】根据图像可判断反应物的总能量低于生成物的总能量,反应是吸热反应。B、D不正确。在选项A中没有标明物质的状态,是错误的,所以正确的答案是C。
查看答案和解析>>
科目: 来源:2012届安徽省高二下学期第二次月考化学试卷(解析版) 题型:选择题
已知反应X+Y= M+N为放热反应,,对该反应的下列说法中正确的 ( )
A、X的能量一定高于M
B、Y的能量一定高于N
C、X和Y的总能量一定高于M和N的总能量
D、因该反应为放热反应,故不必加热就可发生
【解析】考查放热反应和吸热反应的有关概念和判断。在反应中若反应物的总能量低于生成物的总能量,则是吸热反应,反之是放热反应。反应是放热反应还是吸热反应与反应条件无关,所以正确的答案是C。
查看答案和解析>>
科目: 来源:2012届安徽省高二下学期第二次月考化学试卷(解析版) 题型:选择题
在密闭容器里,A与B反应生成C,其反应速率分别用v(A).v(B).v(C)表示,已知2v(B)=3v(A),3v(C)=2v(B),则此反应可表示为( )
A.、2A+3B=2C B、A+3B=2C C、3A+B=2C D、A+B=C
【解析】对于同一个化学反应,不同的物质表示的反应速率是不同的,但表示的意义是相同的,且反应速率之比是相应的化学计量数之比。根据2v(B)=3v(A)、3v(C)=2v(B)可知v(A)︰v(B)︰v(C)=2︰3︰2,所以正确的答案是A。
查看答案和解析>>
科目: 来源:2012届安徽省高二下学期第二次月考化学试卷(解析版) 题型:选择题
常温下,一定量的醋酸与氢氧化钠溶液发生中和反应。下列说法正确的是
A.当溶液中c(CH3COO─)=c(Na+)时,醋酸与氢氧化钠恰好完全反应
B.当溶液中c(CH3COO─)=c(Na+)时,一定是氢氧化钠过量
C.当溶液中c(CH3COO─)=c(Na+)>c(H+)=c(OH─)时,一定是醋酸过量
D.当溶液中c(Na+)>c(CH3COO─)>c(OH─)>c(H+)时,一定是氢氧化钠过量
【解析】若醋酸和氢氧化钠恰好反应,由于生成物醋酸钠水解,溶液显解析,A不正确。根据电荷守恒c(CH3COO─)+c(OH─)=c(Na+)+c(H+)可知,当c(CH3COO─)=c(Na+)时,c(OH─)=c(H+),即溶液显中性,此时醋酸应该是过量的,所以B错误,C是正确的。在选项D中也可能是二者恰好反应,因此D也是错误的。答案选C。
查看答案和解析>>
科目: 来源:2012届安徽省高二下学期第二次月考化学试卷(解析版) 题型:选择题
已知下列热化学方程式:
①CH3COOH(1)+202(g)=2CO2(g)+2H2O(1) △H1= —870.3 kJ·mol—1
②C(s)+O2(g)=CO2(g) △H2= —393.5 kJ·mol—1
③H2(g)+1/2O2(g)=H2O(1) △H3= —285.8 kJ·mol—1
则反应④2C(s)+2H2(g)+O2(g)=CH3COOH(1)的焓变为( )
A、+488.3 kJ·mol—1 B、—224.15 kJ·mol—1
C、 —488.3 kJ·mol—1 D、 +244.15 kJ·mol—1
【解析】考查盖斯定律的应用。将②×3+③×2-①即得到2C(s)+2H2(g)+O2(g)=CH3COOH(1),所以反应热为2△H2+2△H3-△H1=—393.5 kJ/mol×2—285.8 kJ/mol×2+—870.3 Kj/mol=—488.3 kJ/mol,所以正确的答案是C。
查看答案和解析>>
科目: 来源:2012届安徽省高二下学期第二次月考化学试卷(解析版) 题型:选择题
下列方法能使电离平衡H2O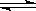 H++OH—向右移动,且使溶液呈酸性的是 ( )
H++OH—向右移动,且使溶液呈酸性的是 ( )
A、向水中加入少量硫酸氢钠固体 B、向水中加入少量硫酸铝固体
C、向水中加入少量碳酸钠固体 D、将水加热到100℃,使水的PH=6
【解析】考查外界条件对平衡的影响。由于水既能电离出氢离子,又能电离出OH-,所以不论是酸还是碱均能抑制水的电离,A不正确。盐类的水解可以促进水的电离,B中水解显酸性,C中水解显碱性,B正确,C错误。温度升高可以促进水的电离,但纯水在任何温度下都是显中性的。答案选B。
查看答案和解析>>
科目: 来源:2012届安徽省高二下学期第二次月考化学试卷(解析版) 题型:选择题
下列表述中正确的是 ( )
A、NH4C1溶液因水解而显酸性,故NH4C1是弱电解质
B、纯碱溶液因水解而显碱性,水解的离子方程式为:CO32—+H2O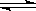 H2CO3+2OH—
H2CO3+2OH—
C、可乐因含碳酸而显酸性,电离方程式为:H2CO3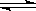 CO32—+2H+
CO32—+2H+
D、配制FeC13 溶液时,先将FeC13 溶于较浓的盐酸中,然后再加水稀释到所需浓度
【解析】溶于水或在熔融状态下部分电离的是弱电解质,全部电离的是强电解质,与物质是否水解无关,A不正确。多元弱酸根水解是分步进行的,B不正确。同样多元弱酸的电离也是分步电离的,所以C也不正确。铁离子水解显酸性,先溶解在浓盐酸中可以抑制铁离子的水解,D正确。
查看答案和解析>>
科目: 来源:2012届安徽省高二下学期第二次月考化学试卷(解析版) 题型:选择题
某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如图所示的变化规律 (图中P表示压强,T表示温度,n表示物质的量,a表示物质的平衡转化率).根据以上规律判断,下列结论中正确的是 ( )

A 、反应Ⅰ:△H>0,p2>p1 B、反应Ⅱ:△H>0,T1>T2
C、反应Ⅰ:△H<0,p2>p1 D、反应Ⅱ:△H>0,T2>T1
【解析】在图像I中,温度越高,转化率越低,所以反应是放热反应。因为反应I是体积减小的可逆反应,即压强越大,反应物的转化率越高。若P1>P2,则不符合,因此是P2>P1,所以A不正确,C正确。在图像Ⅱ中,T1时先达到平衡,所以T1>T2,但温度越高,生成物C的物质的量越低,所以反应是放热反应,因此选项B、D均不正确。答案是C。
查看答案和解析>>
科目: 来源:2012届安徽省高二下学期第二次月考化学试卷(解析版) 题型:选择题
已知反应:mX(g)
+ nY(g)  qZ(g) △H<0,m+n>q,在恒容的密闭容器中反应达到平衡时,下列说法正确的是
( )
qZ(g) △H<0,m+n>q,在恒容的密闭容器中反应达到平衡时,下列说法正确的是
( )
A、通入稀有气体,压强增大,平衡正向移动
B、X的正反应速率是Y的逆反应速率的m/n倍
C、降低温度,混合气体的平均相对分子质量变小
D、增加X的物质的量,Y的转化率降低
【解析】考查外界条件对平衡的影响。该反应是体积减小的放热的可逆反应,若降低温度,则平衡向正反应方向移动,所以混合气体的平均相对分子质量变大,C不正确。通入稀有气体,压强增大,但物质的浓度没有变化,平衡不移动,A不正确。增加X的物质的量,可以增大其他物质的转化率,D也不正确。平衡时正逆反应速率相等,所以根据反应速率之比是相应的化学计量数之比可判断,B是正确的。答案选B。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com