
科目: 来源:2013届浙江省温州市高二期中考试化学试卷(解析版) 题型:填空题
(8分)下图甲池和乙池中的四个电极都是惰性材料,乙池溶液分层,下层为四氯化碳,上层溶液为盐溶液,呈中性,请根据图示回答下列问题:
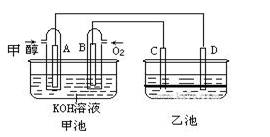
(1)通入甲醇的惰性电极的电极反应式为 。若甲池可以充电,充电时A接电源的负极,此时B极发生的电极反应式为 。
(2)在乙池反应过程中,可以观察到 电极周围的溶液呈现棕褐色,反应完毕后,用玻璃棒搅拌溶液,则下层溶液呈现紫红色,上层接近无色, C极发生的电极反应式为 。
查看答案和解析>>
科目: 来源:2013届浙江省温州市高二期中考试化学试卷(解析版) 题型:填空题
(4分)有可逆反应A+B 2C在不同温度下经过一定时间,混合物中C的百分含量与温度关系如下图所示,那么:
2C在不同温度下经过一定时间,混合物中C的百分含量与温度关系如下图所示,那么:
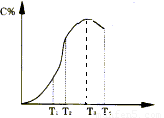 (1)反应在___________________温度下达到化学平衡;
(1)反应在___________________温度下达到化学平衡;
(2)此正反应为______________________热反应;
(3)由T1向T2变化时,V正____________V逆(填>、<、=);
(4)由T3向T4变化时,V正_____________V逆(填>、<、=).
查看答案和解析>>
科目: 来源:2013届浙江省温州市高二期中考试化学试卷(解析版) 题型:实验题
(12分)Na2CO3俗称纯碱、苏打,NaHCO3俗称小苏打,两者在日常生活和工业生产中都有着广泛的应用。某化学兴趣小组设计了如下实验来探究两者的某些性质。请你根据所学知识帮他们完成有关的设计和实验。
(1)甲同学测定两者的酸碱性:各取一定量的固体溶于水,配成相同浓度的溶液,测定其pH值,测定结果为Na2CO3、NaHCO3的pH分别为a和b(a、b均大于7)。
Ⅰ.测定溶液的pH值所用的主要仪器有:pH试纸、表面皿、 和标准比色卡。
Ⅱ.有关①100mL0.1 mol·L-1NaHCO3、②100mL0.1 mol·L-1Na2CO3两种溶液的叙述不正确的是( )
A.溶液中水电离出的OH-个数:②>① B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中:c(CO32-)>c(H2CO3) D.②溶液中:c(HCO3-)>c(H2CO3)
(2)乙同学取一定量的碳酸钠溶液于试管中,滴加2~3滴酚酞试液,发现溶液变红,继续滴加BaCl2溶液,预计可观察到 ,请你结合必要的离子方程式,应用平衡的观点解释有关现象的产生: 。
(3)常温下,现有pH均为11的标签模糊的NaOH和Na2CO3溶液,则NaOH溶液中由水电离出来的OH-浓度为Na2CO3溶液中水电离出来OH-浓度的 倍。丙同学设计如下实验予以区别:各取1mL两种溶液加水稀释至1L,分别测定其pH。请问丙同学是如何判断哪瓶溶液为Na2CO3溶液? ;丁同学各取1mL两种溶液,分别滴加少量AlCl3溶液观察有无沉淀或气体进行鉴别,则溶液滴加后同时产生沉淀和气体的反应离子方程式为 。
(4)已知:Ksp(CaCO3)=4.96×10-9,不考虑其它因素影响,现将0.400 mol·L-1的Na2CO3溶液和0.200 mol·L-1的CaCl2溶液等体积混合,则混合后溶液中Ca2+浓度为 mol·L-1。
查看答案和解析>>
科目: 来源:2013届浙江省温州市高二期中考试化学试卷(解析版) 题型:填空题
(10分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
移动(填“向左”、“向右”或“不”);使用催化剂反应的△H
(填“增大”、“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
移动(填“向左”、“向右”或“不”);使用催化剂反应的△H
(填“增大”、“减小”或“不改变”)。
(2)已知:O2(g) = O2+(g)+e-
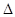 H1=+1175.7 kJ·mol-1
H1=+1175.7 kJ·mol-1
PtF6(g)+e-=PtF6-(g) 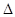 H2=-771.1 kJ·mol-1
H2=-771.1 kJ·mol-1
O2PtF6(S)=O2+(g)+PtF6-(g)
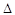 H3=+482.2 kJ·mol-1
H3=+482.2 kJ·mol-1
则反应O2(g)+PtF6(g)
= O2+PtF6-(s)的 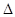 H=_____________ kJ·mol-1。
H=_____________ kJ·mol-1。
(3)已知:2NO2(g)  N2O4(g) △H=-57.2kJ·mol-1。一定温度下,一定体积的密闭容器中充入NO2进行反应:2NO2(g)
N2O4(g) △H=-57.2kJ·mol-1。一定温度下,一定体积的密闭容器中充入NO2进行反应:2NO2(g) N2O4(g)达到平衡。写出该反应的平衡常数表达式: ,升高温度,该反应的平衡常数K值将 (填增大或减小或不变); 若其他条件不变时,下列措施能提高NO2转化率的是 (填字母序号)
N2O4(g)达到平衡。写出该反应的平衡常数表达式: ,升高温度,该反应的平衡常数K值将 (填增大或减小或不变); 若其他条件不变时,下列措施能提高NO2转化率的是 (填字母序号)
 A.减小NO2的浓度 B.降低温度 C.增加NO2的物质的量 D.升高温度
A.减小NO2的浓度 B.降低温度 C.增加NO2的物质的量 D.升高温度
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl-)。则溶液显 性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb= 。
查看答案和解析>>
科目: 来源:2014届浙江省高一3月月考化学试卷(解析版) 题型:选择题
日本福岛第一核电站事故释放出的人工放射性核素碘-131(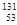 I),被人体超量吸入,可引发甲状腺疾病。下列说法正确的是 ( )
I),被人体超量吸入,可引发甲状腺疾病。下列说法正确的是 ( )
A.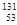 I是一种新元素
B.
I是一种新元素
B. 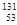 I的摩尔质量为131g
I的摩尔质量为131g
C. 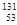 I核内有78个中子
D.碘元素位于周期表第四周期ⅦA族
I核内有78个中子
D.碘元素位于周期表第四周期ⅦA族
查看答案和解析>>
科目: 来源:2014届浙江省高一3月月考化学试卷(解析版) 题型:选择题
下列表示物质结构的化学用语或模型正确的是( )
A.HClO的结构式
H—O—Cl B.HF的电子式: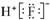
C.CH4分子的球棍模型: D.Cl—离子的结构示意图:
D.Cl—离子的结构示意图: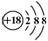
查看答案和解析>>
科目: 来源:2014届浙江省高一3月月考化学试卷(解析版) 题型:选择题
元素性质呈周期性变化的决定因素是 ( )
A.元素原子半径大小呈周期性变化 B.元素相对原子质量依次递增
C.元素原子最外层电子排布呈周期性变化 D.元素的最高正化合价呈周期性变化
查看答案和解析>>
科目: 来源:2014届浙江省高一3月月考化学试卷(解析版) 题型:选择题
下列各组指定原子序数的元素,能形成AB2型离子化合物的是 ( )
A.6和8 B.11和16 C.12和9 D.16和8
查看答案和解析>>
科目: 来源:2014届浙江省高一3月月考化学试卷(解析版) 题型:选择题
下列判断错误的是 ( )
A.酸性:HClO4 >H2SO4 >H3PO4 B.热稳定性:NH3 >PH3>AsH3
C.碱性:NaOH >Mg(OH)2 >Al(OH)3 D.熔点:SiO2 > CCl4 > NaCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com