
科目: 来源:2011-2012学年黑龙江省高三上学期第四次调研考试化学试卷 题型:选择题
用铅蓄电池电解甲、乙电解池中的溶液。已知铅蓄电池的总反应为:Pb(s) + PbO2(s) + 2 H2SO4(aq)  2 PbSO4 (s) +2 H2O (l) 电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是(
)
2 PbSO4 (s) +2 H2O (l) 电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是(
)
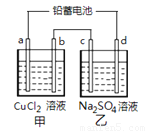
A.d极为阴极
B.若利用甲池精炼铜,b极应为粗铜
C.放电时铅蓄电池负极的电极反应式为:
PbO2(s) + 4 H+(aq)+SO4 2-(aq)+4e- = PbSO4 (s) +2H2O (l)
D.若四个电极材料均为石墨,当析出6.4 g Cu时,两池中共产生气体3.36 L(标准状况下)
查看答案和解析>>
科目: 来源:2011-2012学年黑龙江省高三上学期第四次调研考试化学试卷 题型:选择题
下列实验操作中正确的是( )
A.除去N2中的少量O2:通过灼热的Cu网, 收集气体
B.加入适量NaOH溶液后过滤,以除去KCl溶液中少量的MgCl2
C.除去CO2中的少量HCl:通入Na2CO3溶液,收集气体
D.测溶液的PH值需先用蒸馏水润湿PH试纸,再用干燥洁净的玻璃棒蘸溶液滴在试纸上,与标准比色卡对照
查看答案和解析>>
科目: 来源:2011-2012学年黑龙江省高三上学期第四次调研考试化学试卷 题型:选择题
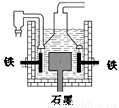
早在1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH(熔)  4Na +O2↑+ 2H2O;后来吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH
4Na +O2↑+ 2H2O;后来吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH  Fe3O4+2H2↑十4Na↑。
Fe3O4+2H2↑十4Na↑。
下列有关说法正确的是 ( )
A.电解熔融氢氧化钠制钠,阳极发生的电极反应为:2OH--2e-=H2↑+O2↑
C.若戴维法与吕萨克法制得等量的钠,则两反应中转移的电子总数也相同
B.吕萨克法制钠原理是利用铁的还原性比钠强
D.目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨为阳极,铁为阴极
查看答案和解析>>
科目: 来源:2011-2012学年黑龙江省高三上学期第四次调研考试化学试卷 题型:选择题
已知某可逆反应aA(g)
+ bB(g)  cC(g)
+ dD(g)。反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如图。下列叙述正确的是
cC(g)
+ dD(g)。反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如图。下列叙述正确的是

A.正反应为吸热反应 B.降低温度,正反应速率增大
C.a + b < c + d D.增大压强,逆反应速率增大
查看答案和解析>>
科目: 来源:2011-2012学年黑龙江省高三上学期第四次调研考试化学试卷 题型:选择题
现取m克铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加bmol/LNaOH溶液,当滴加到VmL时,得到沉淀质量恰好为最大值n克,则下列有关该实验的说法中正确的有( )
①沉淀中氢氧根的质量为(n-m)克
②恰好溶解后溶液中的NO3-离子的物质的量为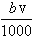 mol
mol
③反应过程中转移的电子数为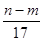 mol
mol
④生成NO气体的体积为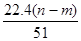 L
L
⑤与合金反应反应的硝酸的物质的量为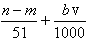 mol
mol
A.2项 B.3项 C.4项 D.5项
查看答案和解析>>
科目: 来源:2011-2012学年黑龙江省高三上学期第四次调研考试化学试卷 题型:填空题
下图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是达到平衡状态的时间。试回答:
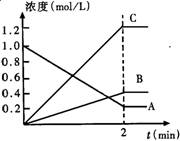
(1)该反应的反应物是______。
(2)该反应的化学方程式为__________。
(3)达到平衡状态的所需时间是2min,A物质的平均反应速率为_______。
查看答案和解析>>
科目: 来源:2011-2012学年黑龙江省高三上学期第四次调研考试化学试卷 题型:填空题
下图涉及的物质所含元素中,除一种元素外,其余均为短周期元素。已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出)。请回答下列问题:
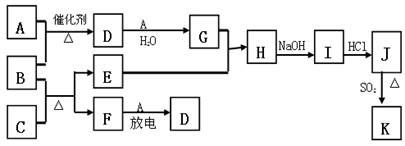
(1)B的电子式为 ;
(2)写出B和C反应的化学方程式 ;
(3)写出E与G的稀溶液反应的离子方程式,并用单线桥标出电子转移的方向和数目:
;
(4)J、K均是同种金属的氯化物,且K为白色沉淀。写出SO2还原J生成K的离子方程式 ;
(5)汽车尾气中常含有D和CO ,二者在催化剂作用下可以大部分转化为两种对空气无污染的物质,已知: F(g) + A(g) = 2D (g) △H = +180.5KJ/mol
2C (s)+ O2 (g)= 2CO(g) △H = -221.0 KJ/mol
C (s)+ O2(g) = CO2(g) △H = -393.5 KJ/mol
则上述尾气转化的热化学方程式为: 。
查看答案和解析>>
科目: 来源:2011-2012学年黑龙江省高三上学期第四次调研考试化学试卷 题型:填空题
A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.回答下列问题:
(1)常温下,X、Y的水溶液的pH均为5.则两种水溶液中由水电离出的H+浓度之比
是 .
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与
足量的Ba(OH)2溶液反应的离子方程式 .
(3)在一个装有可移动活塞的容器中进行如下反应:C2(g)+3A2(g) 2CA3(g)
2CA3(g)
ΔH=-92.4 kJ·mol-1.反应达到平衡后,测得容器中含有C2 0.5mol,A2 0.2mol,CA3 0.2 mol,总容积为1.0 L.
①如果达成此平衡前各物质起始的量有以下几种可能,其中不合理的是________:
A.C2 0.6mol,A2 0.5mol,CA3 0mol B.C2 0mol,A2 0mol,CA3 1.2mol
C.C2 0.5mol/L,A2 0.3mol/L,CA3 0.2mol/L
②若起始加入1.2molC2、1.0molA2,达平衡后C2的浓度为__________mol/L
③如果保持温度和压强不变,向上述平衡体系中加入0.18molC2,平衡将________(填“正向”、“逆向”或“不”)移动.
查看答案和解析>>
科目: 来源:2011-2012学年黑龙江省高三上学期第四次调研考试化学试卷 题型:填空题
有A、B、C、D、E、F六种元素,B原子得到一个电子后3P轨道全充满,A+比B形成的简单离子少一个电子层,C原子的P轨道半充满,它形成的氢化物的沸点是同主族元素的氢化物中最低的;D和E是位于同一主族的短周期元素,E元素的最高化合价与最低化合价的代数和为零,E在其最高价氧化物中的质量分数为46.67%;F元素的核电荷数比C元素大11。请回答:
(1)元素 X与C、B均相邻,比较C、X元素的第一电离能Il(C) I1(x)
(2)写出F元素原子的核外电子排布式 。
(3)位于C元素上周期同主族元素的氢化物沸点最高的原因是 ,其分子中心原子的杂化方式为 ,空间构型为 。
(4)D的最高氧化物是 分子(填“极性”或“非极性”),l mol这种氧化物分子中含有 molπ键,E的最高价氧化物的晶体类型是 。
查看答案和解析>>
科目: 来源:2011-2012学年黑龙江省高三上学期第四次调研考试化学试卷 题型:填空题
某校化学实验小组同学进行有关NO2气体的系列实验。

(1)如上图所示,烧瓶中放有少量铜片,打开分液漏斗
的旋塞,加入过量浓硝酸,烧瓶中产生气体的颜色是 ,试管中收集的气体颜色是 ,用化学方程式表示其原因 ;
(2)将烧瓶浸入冰水中,烧瓶内气体颜色 (填“变深”、“不变”或“变浅”),使用化学用语和必要的文字说明颜色变化的原因 ;
(3)在80℃时,将0.40 mol N2O4气体充入2 L已经抽空的固定容积的密闭容器中发生反应,隔一段时间对该容器内的物质进行分析,得到如下数据:
|
时间(s) |
0 |
20 |
40 |
60 |
80 |
100 |
|
n(N2O4)/mol |
0.40 |
a |
0.20 |
c |
d |
e |
|
n(NO2)/mol |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
①计算a = ,此温度时该反应的平衡常数K= ;
②平衡后,向该容器中再充入0.2molN2O4气体,则N2O4的转化率 (填增大、减小或不变)
③改变条件使反应重新达到平衡,能使c(NO2)/c(N2O4)值变小的措施有(填序号) 。
A.增大N2O4的起始浓度 B.升高温度
C.使用高效催化剂 D.向混合气体中通入稀有气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com