
科目: 来源:2011-2012学年福建省福州市高三第一学期期末质量检查考试化学试卷 题型:填空题
(12分)辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下:

(1)写出浸取过程中Cu2S溶解的离子方程式 。
(2)回收S过程中温度控制在50℃~60℃之间,不宜过高或过低的原因是 、 。
(3)气体NOx 与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为 ;向滤液M中加入(或通入)下列 (填字母)物质,得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾
(4)保温除铁过程中加入CuO的目的是 ;蒸发浓缩时,要用硝酸调节溶液的pH,其理由是 。
查看答案和解析>>
科目: 来源:2011-2012学年福建省福州市高三第一学期期末质量检查考试化学试卷 题型:填空题
(15分)慢心律是一种治疗心律失常的药物,它的合成路线如下:

(1)由B→C的反应类型为 。
(2)C分子中有2个含氧官能团,分别为 和 (填官能团名称)。
(3)写出A与浓溴水反应的化学方程式 。
(4)由A制备B的过程中有少量副产物E,它与B互为同分异构体,E的结构简式为 。
(5)写出同时满足下列条件的D的一种同分异构体的结构简式: 。
①属于α-氨基酸;
②是苯的衍生物,且苯环上的一氯代物只有两种;
③分子中含有两个手性碳原子。
(6)已知乙烯在催化剂作用与氧气反应可以生成环氧乙烷( )。写出以邻甲基苯酚(
)。写出以邻甲基苯酚( )和乙醇为原料制备
)和乙醇为原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:

查看答案和解析>>
科目: 来源:2011-2012学年福建省福州市高三第一学期期末质量检查考试化学试卷 题型:填空题
(12分)纳米氧化亚铜(Cu2O)是一种用途广泛的光电材料,常用的制备方法有电化学法、湿化学法等。电化学法可用铜棒和石墨作电极,电解Cu(NO3)2稀溶液制备。湿化学法的制备过程为:在KOH溶液中加入一定量的CuSO4溶液,再加入一定量的还原剂——肼(N2H4),加热并保持温度在90℃。检验反应完全后,分离、洗涤、真空干燥得到固体样品。反应方程式为:4CuSO4 + N2H4 + 8KOH = 2Cu2O + N2↑+ 4K2SO4 + 6H2O
(1)电化学法制备Cu2O时,铜棒做 极,阴极生成Cu2O的电极反应式为 。
(2)湿化学法中,检验纳米Cu2O已经生成的实验方法是 。
(3)湿化学法得到的产品中常含有Cu。称取某产品1.76 g(设仅含Cu2O和Cu),加入足量的稀硝酸,充分反应后得到标准状况下的NO气体224mL,试计算产品中Cu2O的质量分数。
查看答案和解析>>
科目: 来源:2011-2012学年福建省福州市高三第一学期期末质量检查考试化学试卷 题型:实验题
(15分)Na2O2可用作漂白剂和呼吸面具中的供氧剂。
(1)某学习小组发现:在盛有Na2O2的试管中加入足量水,立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞试液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入少量MnO2粉末,又有气泡产生。
①使酚酞试液变红是因为 ,红色褪去的可能原因是 。
②加入MnO2反应的化学方程式为 。
(2)Na2O2有强氧化性,H2具有还原性,有同学猜想Na2O2与H2能反应。为了验证此猜想,该小组同学进行如下实验,实验步骤和现象如下。
步骤1:按图示组装仪器(图中夹持仪器省略),检查气密性,装入药品;

步骤2:打开K1、K2,产生的氢气流经装有Na2O2的硬质玻璃管,一段时间后,没有任何现象;
步骤3:检验H2的纯度后,开始加热,观察到硬质玻璃管内Na2O2开始熔化,淡黄色的粉末变成了白色固体,干燥管内硫酸铜未变蓝色;
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1。
①盛装稀盐酸的仪器名称 ;B装置的作用是 。
②必须检验氢气纯度的原因是 。
③设置装置D的目的是 。
④你得到的结论是 (若能反应请用化学方程式表示)。
查看答案和解析>>
科目: 来源:2011-2012学年福建省福州市高三第一学期期末质量检查考试化学试卷 题型:填空题
(14分)研究NO2、SO2 、CO等大气污染气体的测量及处理具有重要意义。
(1)I2O5可使H2S、CO、HC1等氧化,常用于定量测定CO的含量。已知:
2I2(s) + 5O2(g)= 2I2O5(s) △H=-75.56 kJ·mol-1
2CO(g) + O2(g)= 2CO2(g) △H=-566.0 kJ·mol-1
写出CO(g)与I2O5(s)反应生成I2(s)和CO2(g)的热化学方程式: 。
(2)一定条件下,NO2与SO2反应生成SO3和NO两种气体。将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO2的同时生成1 molNO
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K= 。
(3)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为 (写出一种即可)。
(4)如图是一种碳酸盐燃料电池(MCFC),以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出B极电极反应式 。
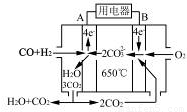
(5)工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例)。
已知:NO不能与Na2CO3溶液反应。
NO + NO2 + Na2CO3 = 2NaNO2 + CO2
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2
①用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则混合气体中NO和NO2的体积比为 。
②用Na2CO3溶液吸收法处理氮的氧化物存在的缺点是 。
查看答案和解析>>
科目: 来源:2011-2012学年福建省福州市高三第一学期期末质量检查考试化学试卷 题型:填空题
过渡元素及其化合物的应用研究是目前科学研究的前沿之一。试回答下列问题:
(1)原子序数小于36的过渡元素A和B,在周期表中位于同一族,且原子序数B比A多1,基态B原子中含有三个未成对电子。请写出B元素在周期表中的位置为 ,A2+在基态时外围电子(价电子)排布式为 。
(2)氯化铬酰(CrO2Cl2)熔点:-96 .5℃,沸点:117℃,能与CH3COCH3(丙酮)、CS2等互溶。则固态CrO2Cl2属于 晶体。已知CS2与NO2+互为等电子体,则1mol NO2+中含有π键数目为 。
(3)二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。有关甲醛、苯、二氧化碳及水说法正确的是 。
a.水的沸点比甲醛高得多,是因为水分子间能形成氢键
b.甲醛、苯和二氧化碳中碳原子均采用sp2杂化
c.苯、二氧化碳是非极性分子,水和甲醛是极性分子
(4)Co3+有多种配合物,如Co(CN)63-、Co(NH3)4Cl2+ 等。铑(Rh)与钴属于同族元素,某些性质相似。现有铑的某盐组成为CsRh(SO4)2·4H2O,易溶解于水,向其水溶液中加入一定浓度的BaCl2溶液,无沉淀生成。请写出该盐溶解于水后的电离方程式: 。
查看答案和解析>>
科目: 来源:2011-2012学年福建省福州市高三第一学期期末质量检查考试化学试卷 题型:实验题
二茂铁(结构如图)是一个典型的金属有机化合物,实验室常用氯化亚铁和环戊二烯在碱性条件下反应得到。反应原理为:FeCl2+2C5H6+2KOH→Fe(C5H5)2+2KCl+2H2O
二茂铁的熔点为172~173℃,在100℃开始升华。能溶于乙醚、二甲亚砜等非极性溶剂,不溶于水,对碱和非氧化性酸稳定。制备的步骤如下:
步骤1.在150mL的三颈瓶中加入25g细粉末状KOH和60mL无水乙醚,通入氮气并搅拌约10分钟使之尽可能溶解,然后加入5.5 mL环戊二烯,再搅拌10分钟。
步骤2. 向烧杯中加入25 mL二甲亚砜和6.5g新制的无水氯化亚铁,微热至40℃并搅拌使其溶解,然后加入滴液漏斗中。
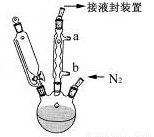
步骤3. 按图所示的装置装配好仪器,打开滴液漏斗的活塞,缓慢将氯化亚铁等加入三颈瓶中,并继续搅拌1小时。
步骤4. 反应结束后,将混合物倒入100mL 18%的盐酸溶液,将烧杯放在冰浴中冷却,搅拌约10分钟,使结晶完全。
步骤5. 抽滤,将获得的产品以冷水洗涤2~3次,低温风干得到粗制的二茂铁。
(1)步骤1中通入N2的目的可能是 。
(2)步骤2中,滴液漏斗侧边的玻璃导管的作用是 。
(3)实验装置中,冷凝管通水,水应从 口进(选填a或b)。
(4)步骤4将反应后的混合物倒入盐酸中,发生主要反应的离子方程式是 。
(5)步骤5用冷水洗涤是因为 ,因此可采用 的方法,进一步提纯二茂铁。
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三上学期期中考试化学试卷 题型:选择题
将SO2气体通入BaCl2溶液至饱和,未见有沉淀生成,继续通入另一种气体仍无沉淀产生,则通入的气体可能是
A. CO2 B. Cl2 C. NH3 D. NO2
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三上学期期中考试化学试卷 题型:选择题
现有100mLMgCl2和AlCl3的混合溶液,其中c(Mg2+)=0.30mol·L-1,c(Cl-)=1.20mol·L-1,要使Mg2+完全转化为Mg(OH)2且与Al3+恰好分开,至少需要1.00 mol·L-1的NaOH溶液的体积为
A.80 mL B.100 mL C.120 mL D.140 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com