
科目: 来源:2011-2012学年福建省高三上学期期中考试化学试卷 题型:选择题
实验室中,通常以草酸钠(Na2C2O4)为标准液,通过氧化还原滴定来测定高锰酸钾溶液的浓度,其反应的化程程为:C2O42—+MnO4—+H+—Mn2++CO2↑+H2O(未配平)下列有关草酸钠滴定高锰酸钾实验的叙述,正确的是
A.配制草酸钠标准液时,直接将Na2C2O4固体溶于容量瓶的水中即可
B.滴定过程中,高锰酸钾被氧化,草酸钠被还原
C.该反应中,消耗的草酸钠与高锰酸钾物质的量之比为5:2
D.为便于滴定终点的判断,滴定时必须往体系中加入指示剂
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三上学期期中考试化学试卷 题型:选择题
将1.28 g Cu投入一定量的浓HNO3溶液中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下的气体448mL,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的氧气,恰好使气体完全溶于水,则通入的氧气的体积为
A.112 mL B.224 mL C.336 mL D.448 mL
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三上学期期中考试化学试卷 题型:选择题
如下图,利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面.下表中对实验现象所做的解释正确的是
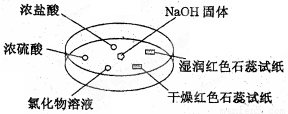
A.浓盐酸附近产生白烟:NH3与HCI气体反应产生了NH4C1固体
B.浓硫酸附近无明显现象:NH3与浓硫酸不发生反应、
C.氯化物溶液变浑浊:该溶液一定是A1CI3溶液
D.干燥红石蕊试纸不变色,湿润的红石蕊试纸变蓝:NH3是一种可溶性碱
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三上学期期中考试化学试卷 题型:选择题
反应①、②分别是从海藻灰和智利硝石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4 +2H2O+I2
②2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2
下列说法正确的是
A.两个反应最终都能使溶液的酸性增强
B.碘元素在反应①中被还原,在反应②中被氧化
C.氧化性:MnO2>SO42—>IO3—>I2
D.反应①、2中生成等量I2时转移电子数之比为1:5
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三上学期期中考试化学试卷 题型:选择题
现有含Fe(NO4)3、Cu(NO3)2,HNO3的某稀溶液,若向其中逐步加入铁粉,溶液中Fe2+浓度与加入铁粉的物质的量之间的关系如图,则该溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为
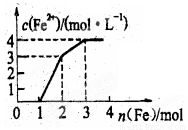
A.1:1:1 B.1:1:4
C.1:3:1 D.3:3:8
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三上学期期中考试化学试卷 题型:填空题
(8分)现有A、B;C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与.C的最外层电子数相等,A能分别与B、,C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子。请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关);
(1)A~F六种元素原子,原子半径最大的是 (填序号),B元素在元素周期表中的位置 。
(2)D与E可形成化合物D2E,该化合物的电子式为 。
(3)A、C、E三种元素形成的一种常见化合物,其浓溶液在加热条件下可与铜反应,该反应的化学方程式为 。
(4)比较E、F气态氢化物的稳定性: > (用分子式表示)。
(5)B与F两种元素形成的一种化含物分子,各原子均达8电子结构,其中B显负价,F显正价,则该化合物与水反应的化学方程式为 。
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三上学期期中考试化学试卷 题型:实验题
(11分)某些化学反应可表示为:A+B=C+D十H2O(未配平,条件略)。请回答:
(1)若A为主族元素,A与B的浓溶液在常温时发生钝化,但A与B的稀溶液反应产生无色气体并能迅速转化为红棕色。请写出A与B的稀溶液反应的化学方程 。
(2)若A、D均可用于消毒,,且C是家家户户的厨房必备的物质之一,写出该反应的离子方程式 。
(3)若A为黑色固体,C是黄绿色的单质气体。当产生标准状况下33.6LC气体时,参加反应的A的质量为 。
(4)已知炭和浓硫酸在加热时也符合上述反应式,某同学设计如下实验证明其产物。则:

若证明有水生成,需要在.A、B之间加装盛有 的干燥管。若证明生成CO2,需要C试管盛放 (填化学式)溶液。装置B可以探究SO2与品红作用的可逆性,请写出实验操作及现象 ;该实验的尾气可采用NaOH溶液吸收,有关反应离子方程式为 。
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三上学期期中考试化学试卷 题型:实验题
(12分)某研究性学习小组为测定,13.7g某Na2CO3样品的纯度(其中只含NaHCO3杂质),选用下图所示的仪器装置进行实验(②装置未画全)。试回答有关问题:
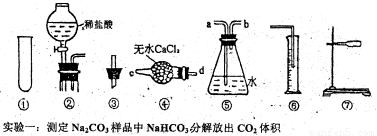
(1)请选择适当的仪器,连接装置的正确顺序是_ 。
(2)加热时NaHC03分解的化学方程式为 。
(3)完成该实验尚缺的玻璃仪器是 (填名称);产生气体从装置④的 进入,从装置⑤的 进入(填接口序号)。
实验二:测定上述实验完成后剩余固体与盐酸反应产生CO2的体积。
(4)加热后的固体与足量盐酸反应的离子方程式为 。
数据分析及结论:
(5)加入盐酸至无气体产生时,生成CO2体积在标准状况时为2.24L,则Na2CO3样品的纯度为 。
误差分析:
(6)有同学认为实验一⑤中用水会使测量结果产生误差,你认为原因可能是 。
(7)有同学发现在实验—读取CO2体积时,⑥中液体的液面低于⑤中液体的液面,但未做任何处理,则a值 (填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三上学期期中考试化学试卷 题型:填空题
(9分)某厂的酸性工业废水中含有一定量的。Fe3+、Cu2+等离子。有入设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中生产一定量的铁红和氧化铜。
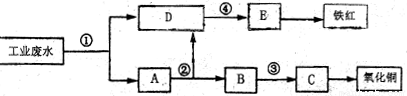
填写下面空白:
(1)图中标号②处需加入的相应物质是
(2)若需证明D溶液中是否含有Fe3+,需要选择的试剂是 (填化学式)。
(3)写出①处发生反应的离子方程式 。
写出③处发生反应的化学方程式 。
(4)铁红的化学式为 ,写出铁红在工业上的一种主要用途 。
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三上学期期中考试化学试卷 题型:填空题
(12分)海水中蕴藏着丰富的资源,海水综合利用的流程图如下。

(1)用NaC1做原料可以得到多种产品。
①工业上由NaC1制备58.5kg金属钠时,可生成标准状况下的氯气 L。
②实验室用惰性电极电解氯化钠稀溶液可制备“84消毒液”,通电时产生的氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式 。
(2)分离出粗盐后的卤水中蕴含丰富的镁资源,经转化后可获得MgC12粗产品。租产品的溶液中含有的Fe3+、Fe2+、Mn2+转化为沉淀除去;Fe(OH)3呈絮状,常将其转化为Fe(OH)3而除去(生成氢氧化物沉淀的pH见表)。

若只加入题(1)中得到的一种产品即可达到上述除杂目的,则该产品的化学式为 ,最终控制溶液的pH值为 。MgC12粗产品在精制净化后,熔融、电解可得镁单质。环境专家认为可以用金属镁将水体中的NO3—还原为N2,从而消除污染。请补充完整以下离子方程式并配平:
NO3—+ Mg+ H2O= N2↑+ Mg(OH)2+
(3)碘在地壳中主要以NaIO3形式存在,在海水中主要以,I—的形式存在。几种粒子之间有如下转化关系:

①如以途径I制取I2,加的、C12要适量;如过量就会发生途径Ⅲ的副反应,在该副反应产物中,IO3—。与C1—物质的量之比1:6,则氧化剂剂还原剂物质的量之比为 。
②如以途径Ⅱ在溶液中制I2,反应后溶液显酸性,则反应的离子方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com