
科目: 来源:2011-2012学年福建省高三第二次月考化学试卷 题型:选择题
某学生用质量为ag、边长为bcm的正方形镀锌铁片与过量盐酸反应测定镀层厚度,并将实验结果绘图示意,反应完毕后铁片质量为cg(已知锌的密度为 g/cm3)。
g/cm3)。
下列叙述错误的是( )

A.t1时刻锌镀层已完全反应
B.锌镀层的厚度小于
C.反应放热也是影响OA段的反应速率的因素之一
D.有原电池反应发生,负极的电极反应式为2H++ 2e→H2↑
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三第二次月考化学试卷 题型:选择题
下列关于物质分离和提纯的方法不正确的是 ( )
A.CuC12酸性溶液中含有少量FeC13:加入Cu(OH)2调节溶液pH=4,再过滤
B.除去Na2CO3晶体的结晶水及少量NaHCO3:放置于瓷坩埚中,灼烧至质量不再减轻
C.CaCO3中混有少量CaSO4:加入饱和Na2CO3溶液,充分搅拌过滤,再用水多次洗涤沉淀
D.除去氮气中的少量氧气:将气体缓缓通过过量灼热的铜
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三第二次月考化学试卷 题型:选择题
工业上用铝土矿(主要成分为Al2O3,含SiO2、Fe2O3等杂质)为原料冶炼铝的工艺流程如下:对上述流程中的判断正确的是 ( )

A.试剂X为稀硫酸,沉淀中含有硅的化合物
B.反应II中生成Al(OH)3的反应为:[A1(OH)4] +CO2=A1(OH)3↓+HCO3—
C.结合质子( H+)的能力由强到弱的顺序是:[Al(OH)4]->OH一>CO32—
D.Al2O3熔点很高,工业上还可采用电解熔融A1Cl3的方法冶炼Al
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三第二次月考化学试卷 题型:选择题
某同学通过系列实验探究Mg及其化合物的性质,操作正确且能达到目的的是 ( )
A.将水加入浓硫酸中得到稀硫酸,置镁片于其中探究讨Mg的活泼性
B.将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成
C.将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀
D.将Mg(OH)2沉淀转入表面皿中,加足量稀盐酸,加热蒸干得无水MgC12固体
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三第二次月考化学试卷 题型:选择题
(20分)A、B、C三种常见物质中均含有同一种元素,它们之间有如下图所示的转化关系(部分反应物质已略去)。

(1)若A是一种两性氧化物,B的水溶液呈酸性,C的水溶液呈
碱性,请写出A、B、C三种物质中含有的同一种金属元素的原子
结构示意图_ B溶液显酸性的原因(用离子方程式
表示) ,反应④的离子方程式 。
(2)若A为一种金属单质时,反应①②③均为化合反应,反应④为置换反应。请写出③可能的离子方程式 和工业冶炼A的化学方程式_ 。
(3)若A、B、C是三种不同类别的气态物质,均能被同一种单
质氧化,写出实验室采用右图所示装置制取A的化学方程式________,
 检验A气体是否集满的方法是
。
检验A气体是否集满的方法是
。
(4)若A、B、C是三种不同类别的固态物质,C是一种既含有离子
键又含有共价键的化合物,溶于水电离出两种相同电子数的离子,
B是工业上制取A、C的原料。实验室保存少量单质A的方法是____ 。写出工业采用B制取C的离子方程式___ ;浓度均为0.5 mol.L-1的B、C溶液,导电能力比较强的是________(填化学式)溶液。
(5)若A、B均是可燃性物质,完全燃烧都生成气体C,
常温下A溶液pH<7,将C通入A溶液中,pH值先增
大后减小。

①将C通入右图所示装置中,可以制得强电解质D的溶液,写出气体C发生的电极反应式
②该装置中H+的作用是 和
③若转移的电子数为6.02×1022时,左槽n(H+)的变化量
为________。
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三第二次月考化学试卷 题型:选择题
(9分)随着环保意识增强,清洁能源越来越受到人们关注。
(1)甲烷是一种理想的洁净燃料。已知:
CH4(g)+2O2(g)= CO2(g)+2H2O(g);△H= —802.3kJ·mol-1
H2O(1) =H2O(g),△H =+44.0kJ·mol-l
则4.8g甲烷气体完全按燃烧生成液态水,放出热量为 。
(2)利用甲烷与水反应制备氢气,因原料廉价,具有推广价值。
该反应为CH4(g)+H2O(g)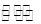 CO(g)+3H2(g);△H=+206.lkJ·mol-l。
CO(g)+3H2(g);△H=+206.lkJ·mol-l。
①若800℃时,反应的化学平衡常数K=l.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表。

则此时正、逆反应速率的关系是 。(填标号)
A.v(正)>v(逆) B.v(正)<v(逆)
C.v(正)=v(逆) D.无法判断
②为了探究温度、压强对上述化学反应速率的影响,某同学设计了以下三组对比实验(温度为360℃或480℃、压强为101 kPa或303 kPa,其余实验条件见下表)。
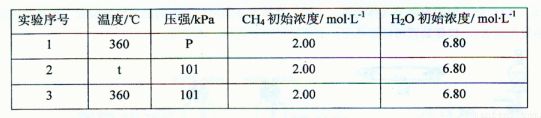
表中t= ,P= ;
设计实验2、3的目的是
实验l、2、3中反应的化学平衡常数的大小关系是 (用K1、K2、K3表示)。
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三第二次月考化学试卷 题型:选择题
(20分)已知某化工厂的含镍催化剂主要含有Ni,还含有Al (31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。某校化学研究性学习小组通过查阅资料,设计了如下图所示的方法以该含镍废催化剂为原料来制备NiSO4·7H2O。

回答下列问题:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为 。
(2)“碱浸”的目的是除去 。
(3)“酸浸”时所加入的酸是 (填化学式)。酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是 。
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是 。
(5)“调pH为2~3“的目的是 。
(6)产品晶体中有时会混有少量绿矾(FeSO4·7H2O),其原因可能是 。
(7) NiSO4在强碱溶液中用次氯酸钠氧化,可以制得碱性镍镉电池电极材料——NiOOH。该反应的离子方程式___ 。
(8)一般认为残留在溶液中的离子浓度小于1×10-5 mol/L时,沉淀已经完全。请利用上表中数据估算Fe(OH)2的溶度积
和可逆反应Fe2++ 2H2O 2H++
Fe(OH)2在25℃时的平衡常数
2H++
Fe(OH)2在25℃时的平衡常数
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三第二次月考化学试卷 题型:选择题
(15分)如图为常见气体制备、干燥、性质验证和尾气处理的部分仪器装置(加热及固定装置均略去),仪器装置可任意选用,必要时可重复选择,请完成:
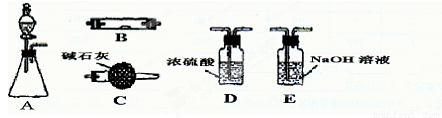
(1)若装置A的锥形瓶中装锌片,分液漏斗中装稀硫酸,则可验证H2的还原性并检验其氧化产物。
①若按顺序A→C→B→C连接仪器装置时,两次使用B装置,其中所盛的药品的化学式依次为CuO、 。
②检查装置的气密性后,加热装置B前必须进行的操作是_ 。
(2)若装置A的锥形瓶中装Na2O2,分液漏斗中装浓氨水,装置B中装红热的铂网可以进行氨的催化氧化;
①装置A的锥形瓶中反应的化学方程式为_ 、 ;
若气流按从左到右连接顺序A→D→B→B→C的方向,则B中氨的催化氧化反应方程式为 。
②装置B中除了观察到铂网保持红热外,还可能观察到的现象是 。
(3)若装置A的锥形瓶中装Na2SO3固体,分液漏斗中装70%的H2SO4溶液,装置B中装Na2O2固体,根据A→D→B→C的气流方向充分反应,探究SO2气体与Na2O2反应的是否生成O2。该实验中C装置的作用是 。
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三第二次月考化学试卷 题型:实验题
(20分)某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:
【探究一】设计右图所示装置进行“铁与水反应”的实验。

(1)硬质试管中发生反应的化学方程式为 。
(2)反应前A中投放碎瓷片的目的是 。
(3)装置E中的现象是 。
【探究二】设计如下实验方案确定反应后硬质玻璃管中黑色固体的成分。
(4)待硬质试管B冷却后,取少许其中的固体物质溶于 后,将所得溶液分成两份。
(5)一份滴加几滴KSCN溶液。若溶液变红色,推断硬质玻璃管B中固体物质的成分(选填序号,下同) 。;若溶液未变红色,推断硬质玻璃管B中固体物质的成分
①一定有Fe3O4,可能有Fe ②Fe3O4和Fe ③只有Fe3O4 ④只有Fe
(6)另一份用___ (填仪器名称)加入 ,可以证明溶液中存在Fe2+。
【探究三】设计如下流程利用上述滤液制取绿矾晶体(FeSO4·7H2O)。
滤液 FeSO4溶液
FeSO4溶液 FeSO4·7H2O晶体
FeSO4·7H2O晶体
(7)步骤I中加入洁净废铁屑的作用是 (用化学方程式表示)。
(8)步骤II从FeSO4稀溶液中得到FeSO4·7H2O晶体的主要操作包括 、趁热过滤____、再过滤。为防止FeSO4变质,该流程中还需注意的问题有 。
【探究四】设计如下流程测定反应后硬质玻璃管B中固体含铁元素的质量分数。
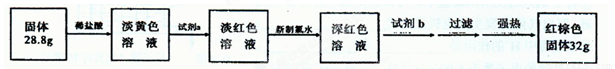
(9)试剂b的化学式是 ____。
(10)计算反应后B装置中铁元素的质量分数为 ;根据计算结果判断反应后硬质试管B中固体物质的成分是 。
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三上学期10月份月考化学试卷 题型:选择题
下列叙述中,正确的是( )
A.含最高价元素的化合物,一定具有强氧化性
B.阳离子只有氧化性,阴离子只有还原性
C.失电子越多,还原能力越强
D.强氧化剂与强还原剂不一定都能发生氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com