
科目: 来源:2011-2012学年福建省高三上学期第一次月考化学试卷 题型:选择题
在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρg·cm-3,溶质的质量分数为ω,溶质的物质的量浓度为C mol/L。下列叙述中正确的是 ( )
①ω= ②C=
②C=
③上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
④上述溶液中再加入1.5VmL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:
c(Cl-) > c(NH4+) > c(H+) > c(OH-)
A.①④ B.②③ C.①③ D.②④
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三上学期第一次月考化学试卷 题型:选择题
将NaCl和NaBr的混和物mg溶于足量的水配成500mL的溶液A,再向其中通入足量的氯气,充分反应后蒸发至干,得干燥晶体(m-2)g,则A溶液中Na+、Br-、Cl-的物质的量浓度之比不可能为 ( )
A.3︰2︰1 B.3︰1︰2 C.3︰1︰4 D.4︰3︰1
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三上学期第一次月考化学试卷 题型:选择题
现有A、B、C三种化合物,各取40g相混合,完全反应后,得到18.0g B、49.0g C、还有D生成,已知D的式量为106。现将20.0g A和11.0g B反应,能生成D的物质的量为( )
A.1.00mol B.0.500mol C.0.275mol D.0.250mol
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三上学期第一次月考化学试卷 题型:选择题
设阿伏加德罗常数为NA。则下列说法正确的是 ( )
A.常温常压下,18.0 g重水(D2O)中所含的电子数为10 NA
B.1cm3铁所含的铁原子数是ρ·NA/56(ρ是铁的密度,单位为g·cm-3)
C.2.24LCO2与足量的Na2O2反应,Na2O2转移的电子总数一定为0.1NA
D.常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三上学期第一次月考化学试卷 题型:填空题
(8分)K2Cr2O7(橙色)、Cr2(SO4)3(绿色)、K2SO4、H2SO4、C2H5OH、CH3COOH和H2O分别属于同一氧化还原反应中的反应物和生成物,该反应原理可以用于检查司机是否酒后开车。
(1)该反应中的还原剂是________________。
(2)若司机酒后开车,检测仪器内物质显示出 色。
(3)在反应中,铬元素的化合价从 价变为 价。
(4)写出并配平该反应的化学方程式。
(5)如果在反应中生成1mol氧化产物,转移的电子总数为 。
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三上学期第一次月考化学试卷 题型:填空题
(10分)W、X、Y、Z四种短周期元素在元素周期表中的位置如右图所示,其中Z位于ⅦA族。

请回答下列问题。
(1)W的原子结构示意图为 。能说明Z的非金属性比X的非金属性强的事实是 (举一例)。
(2)W、Y和氢3种元素所形成的一种化合物,其75%(体积分数)的溶液常用于医疗消毒,该化合物的结构简式为 。用化学方程式表示该化合物在中学实验室的一种用途 。
(3)电解NaZ水溶液时,阴极的电极反应式为 。工业上,以上述反应的阳极产物和Ca(OH)2为原料,制备漂白粉反应的化学方程式为 。
(4)已知:298K时,金属钠与Y2气体反应,生成1 mol Na2Y固体时,放出热量414 kJ;生成1 mol Na2Y2固体时,放出热量511 kJ。由Na2Y固体与Y2气体反应生成Na2Y2固体的热化学方程式为 。
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三上学期第一次月考化学试卷 题型:填空题
(10分)某些化学反应可用下式表示:A + B C + D + H2O,请回答下列问题:
(1)若A、D均可用于消毒,且C是家家户户的厨房必备的物质之一,写出该反应的离子方程式: 。
(2)若A为水垢的主要成分之一,B是日常生活常见有机物,写出该反应的化学方程式: 。
(3)若A为黑色固体,C是黄绿色的单质气体,写出该反应的离子方程式: 。
(4)若A为亮红色单质,B为第二周期某种元素的最高价氧化物的水化物,A、B、C、D中只有D是气体,若D无色,写出该反应的化学方程式: 。
(5)若C、D均为气体且都能使澄清石灰水变浑浊,则只用 或 (任写两种试剂的名称)就可以鉴别C、D两种气体。
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三上学期第一次月考化学试卷 题型:填空题
(12分)奥运五环“象征五大洲的团结,全世界的运动员以公正、坦率的比赛和友好的精神,在奥运会上相见”。右下图所示五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素;五种化合物由四种短周期元素形成,每种化合物仅含有两种元素。A是工业制取硝酸的主要原料之一;B、E分子中所含电子数都为18,B不稳定,具有较强的氧化性,E是由六个原子构成的分子,可作火箭燃料;C是工业制光导纤维的主要原料;D中所含的两种元素的原子个数之比为3∶4。根据以上信息回答下列问题:

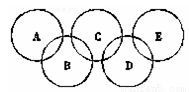
(1)A用于工业制取硝酸所发生反应的化学方程式 。
(2)D的化学式是 ,E分子中含有 键和 键。
(3)B的水溶液呈弱酸性,其电离方程式可表示为 ,B在实验室中可以用于制取某种常见气体,其反应的化学方程式为 。
(4)B与E反应可生成单质G和一种常见的液体H,其反应的化学方程式为
。
(5)用化学方程式表示C的另一种用途 。
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三上学期第一次月考化学试卷 题型:实验题
(14分)实验室需要0.80 mol/L NaOH溶液475 mL和0.40 mol/L硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:

(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),配制上述溶液还需用到的玻璃仪器是 (填仪器名称)。
(2)下列操作中,容量瓶所不具备的功能有 (填序号)。
A.配制一定体积准确浓度的标准溶液
B.量取一定体积的液体
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.贮存溶液
F.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为 g。在实验中其他操作均正确,若定容时俯视视刻度线,则所得溶液浓度 0.8 mol/L(填“大于”、“等于”或“小于”,下同)。若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度 0.8 mol/L。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为 mL(计算结果保留一位小数)。如果实验室有10 mL、15 mL、20 mL、50 mL量筒,应选用
mL量筒最好。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com