
科目: 来源:2011-2012学年福建省高三上学期期中考试化学试卷 题型:选择题
X、Y、Z、W有如图所示的转化关系,则X、W可能是( )

①C、O2 ②AlCl3、NaOH ③Fe、HNO3 ④S、O2
A.①②③ B.①② C.③④ D.①②③④
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三上学期期中考试化学试卷 题型:选择题
拟用右图所示装置制取四种干燥、纯净的气体(图中加热装置和气体的收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中不能达到目的的是( )

|
选项 |
制取气体 |
a |
b |
c |
D |
|
A |
NO |
稀硝酸 |
铜片 |
H2O |
浓硫酸 |
|
B |
O2 |
双氧水 |
MnO2 |
H2O |
浓硫酸 |
|
C |
NH3 |
浓氨水 |
碱石灰 |
浓硫酸 |
H2O |
|
D |
SO2 |
浓盐酸 |
Na2SO3粉末 |
NaHSO3溶液 |
浓硫酸 |
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三上学期期中考试化学试卷 题型:选择题
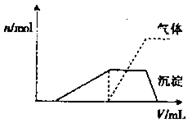
某稀硫酸和稀硝酸的混合溶液200 mL,将其分成两等份。向第一份中逐渐加入铜粉,最多能溶解19. 2 g(假设硝酸仅被还原为NO气体,下同)。向第二份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是( )

A .原混合溶液中 的物质的量为
的物质的量为
B. OA段、BC段产生的气体分别是
C. 第二份溶液中最终溶质为FeSO4
D. 原混合溶液中H2SO4的浓度为
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三上学期期中考试化学试卷 题型:填空题
(9分)建筑工地常用的NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:


(1)配平并标出电子转移的方向和数目。
(2)上述反应的氧化剂是 ;若有1 mol的还原剂被氧化,则反应中转移电子的的数目是 。
(3)根据上述反应,可用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:① 水 ② 碘化钾淀粉试纸 ③ 淀粉 ④ 白酒 ⑤ 食醋,进行实验,下列几组合适的是 (填序号)。
A.③⑤ B.①②④
C.①②⑤ D.①②③⑤
(4)某厂废切削液中,含有2%—5%的NaNO2,直接排放会造成污染,采用NH4Cl,能使 NaNO2转化为不引起二次污染的N2,反应的化学方程式为 ;该反应中被氧化的元素是 。
(5)采用烧碱处理硝酸工业尾气可以获得副产品NaNO2,变废为宝。若采用a L b mol/L的烧碱处理硝酸工业尾气,最多可以获得NaNO2的物质的量为 mol。
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三上学期期中考试化学试卷 题型:填空题
(9分)1 L某混合溶液,可能含有的离子如下表:
|
可能大量含有的阳离子 |
H+ NH4+ Al3+ K+ |
|
可能大量含有的阴离子 |
Cl- Br- I‑ ClO‑ AlO2- |
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量( )与加NaOH溶液的体积(
)与加NaOH溶液的体积(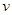 )的关系如右图所示。则该溶液中确定含有的离子有_______________;
)的关系如右图所示。则该溶液中确定含有的离子有_______________;
不能确定是否含有的阳离子有__________,要确定其存在可补充做的实验是________;
(2)经检测,该溶液中含有大量的Cl- 、Br-、I-,若向1 L该混合溶液中通入—定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积标准状况)的关系如下表所示,分析后回答下列问题:
|
Cl2的体积(标准状况) |
2.8L |
5.6 L |
11.2 L |
|
|
1.25mol |
1.5 mol |
2 mol |
|
|
1.5 mol |
1.4 mol |
0.9 mol |
|
|
|
0 |
0 |
①当通入Cl2的体积为2.8 L时,溶液中发生反应的离子方程式为___ 。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为_____________。
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三上学期期中考试化学试卷 题型:填空题
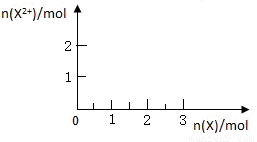
(10分)图中X、Y、Z为单质,其他为化学物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁;E是不溶于水的酸性氧化物,能与氢氟酸反应。

回答下列问题:
(1)元素X在元素周期表中的位置为第________周期________族。
(2)一定条件下,Z能与H2反应生成ZH4 ,写出Z与NaOH反应的化学方程式
(3)写出由Y与NO、H2O生成D反应的化学方程式: 。
(4)X在高温下能与水蒸气反应,请写出该反应的化学方程式:
(5)向含4mol D的稀溶液中,逐渐加入X粉末至过量。假设生成的气体只有一种,请在坐标系中画出n(X2+)随n(X)变化的示意图,并标出n(X2+)的最大值。
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三上学期期中考试化学试卷 题型:填空题
(10分).近年来,江苏省酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
⑴有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下: ( I )将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液。(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。(III)将盐酸加入NaHSO3溶液中得SO2气体回收,生成的NaCl循环利用。
① 写出步骤(I)反应的化学方程式:
② 写出步骤(III)反应的离子方程式:
⑵还有学者提出利用 Fe 2十、Fe3十等离子的催化作用,常温下将SO2氧化成SO42一而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42一的转化率。

① 该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是(填序号) 。(参考:还原性SO2 > I- >Br->Cl-) 
A.碘的淀粉溶液 B.酸性高锰酸钾溶液
C.氢氧化钠溶液 D.氯化钡溶液
② 若上述实验是在标准状况下进行的,X是已知体积和物质的量浓度的溶液,欲测定转化器中SO2氧化成SO42一的转化率,已知气体流速,还需测定的数据是 和加入盐酸酸化的氯化钡溶液后生成沉淀的质量。
(3)
为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2。该方法涉及到的化学反应为:SO2+2CO=2CO2+ Sx 、
Sx 、
CO+ Sx=COS、2COS+SO2=2CO2+
Sx=COS、2COS+SO2=2CO2+ Sx 。其中COS中“C”化合价为 。
Sx 。其中COS中“C”化合价为 。
(4)若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在消化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后加入甲醇(CH3OH),NO3-和甲醇转化为两种无毒气体。请写出加入甲醇后反应的离子方程式 。
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三上学期期中考试化学试卷 题型:填空题
(14分). 复印机使用的墨粉主要成分是Fe3O4,下图是氧化沉淀法生产Fe3O4的工艺:

已知:① 工业绿矾中FeSO4的含量为52.5%,其中的杂质不参与反应;
② Fe(OH)2+2Fe(OH)3=Fe3O4·4H2O
③ 12.16﹡1000﹡52.5%=6384, 6384/152=42请回答下列问题:
(1)铁的常见氧化物有 ;
(2)Fe3O4与稀硝酸反应的离子方程式是 ,检验反应后的溶液中含Fe3+的方法 ;
(3)在工艺流程中,通入适量空气“氧化”时的化学方程式是: ;
(4)生产中可获得的副产品是 ,提取该副产品的操作顺序是 (填写序号)
a.过滤 b.加热浓缩 c.冷却 d.结晶 e.洗涤
(5)在生产过程中,若工业绿矾的投料速率是12.16 kg/h,为使产品较纯,鼓入空气的速率应为 L/h(假设反应在标准状态下进行,空气中O2占20%)。
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三上学期期中考试化学试卷 题型:填空题
(8分)某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。

请回答下列问题:
(1)装置F中发生反应的离子方程式为__________________________________________。
(2) B装置的名称是___________________;E装置的作用__________________________。
(3)通入C装置的两根导管左边较长、右边较短,目的是___________________________。
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:________________________________________________。
查看答案和解析>>
科目: 来源:2011-2012学年福建省高三12月月考化学试卷 题型:选择题
下列说法错误的是
A. 清晨茂密树林中缕缕阳光穿过枝叶铺洒在地面形成的美丽景色与胶体的性质有关
B. 元素周期律是元素原子核外电子排布随着元素核电荷数的递增发生周期性变化的必然结果
C. 尿素[CO(NH2)2]的合成突破了无机物和有机物的界限,人们用含碳无机物为原料合成了大量的有机物,创造了一个新的“自然界”
D.Na2CO3俗名小苏打,是焙制糕点所用发酵粉的主要成分之一
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com