
科目: 来源:2011-2012学年浙江省高三10月份月考化学试卷 题型:选择题
氮化硅(SiN4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2+6C+2N2 Si3N4+6CO。下列叙述正确的
A.在氮化硅的合成反应中,N2是还原剂,SiO2是氧化剂
B.上述反应中每生成1molSi3N4,N2得到12mol电子
C.若已知上述反应为放热反应,升高温度,其平衡常数增大
D.若使压强增大,上述平衡向正反应方向移动
查看答案和解析>>
科目: 来源:2011-2012学年浙江省高三10月份月考化学试卷 题型:选择题
某溶液仅含Fe2+、Na+、A13+、Ba2+、SO42—、NO3—、C1—中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气体产生,且溶液中阴离子种类不变(不考虑水的电离和盐类水解)。下列说法不正确的是
A.该溶液所含的离子:Fe2+、Na+、SO42—、NO3—
B.若向该溶液中加入过量的稀硫酸,产生的气体在空气中能变红棕色
C.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色
D.若向该溶液中加足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g
查看答案和解析>>
科目: 来源:2011-2012学年浙江省高三10月份月考化学试卷 题型:填空题
(6分)某一反应体系中的物质有:HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O,
已知:As是产物之一。
(1)写出并配平该反应的化学方程式 ______________
(2)在反应中,每转移1 mol电子,消耗(或生成)HCl_______mol;
(3)下列叙述正确的是_____________(填写序号)。
a.在相同条件下,第VIIA族元素的阴离子的还原性从上到下逐渐增强
b.Sn和Pb位于同一主族,其+4价的化合物均很稳定
c.在相同条件下,还原性顺序:S2->I->Fe2+>Br->Cl-
d.在上述反应中,氧化性:SnCl2 >As,还原性:H3AsO3>H2SnCl6
查看答案和解析>>
科目: 来源:2011-2012学年浙江省高三10月份月考化学试卷 题型:填空题
(3分)一个体重50 kg的健康人身体中含铁2 g。铁在人体中不是以游离态的形式存在,而是以Fe2+和Fe3+形式存在。Fe2+易被吸收,给贫血者补充铁时,应给予含Fe2+的盐,如硫酸亚铁(FeSO4)。人体中经常进行Fe2+和Fe3+的转化,服用维生素C,可使食物中的Fe3+转化为Fe2+”,说明维生素C具有 性。
(2)羟胺(NH2OH)是一种还原剂,用25.00 mL 0.049 mol/L羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+离子恰好与24.5 mL 0.020 mol/L的KMnO4酸性溶液反应。则在上述反应中,羟胺的氧化产物是 。
查看答案和解析>>
科目: 来源:2011-2012学年浙江省高三10月份月考化学试卷 题型:填空题
(3分)酸性条件下,许多氧化剂可使KI溶液中的I-氧化,例如KIO3(IO3-→I2)、H2O2(H2O2→H2O)、FeCl3(Fe3+→Fe2+)、K2Cr2O7(Cr2O72-→Cr3+)。请根据题目要求填空:
(1)写出在醋酸存在的条件下KIO3溶液与KI溶液反应的离子方程式 。
(2)在酸性条件下(足量),各取1 L浓度为1 mol·L-1的KI溶液分别与上述列举四种溶液进行完全反应,则需要溶质的物质的量之比为n(KIO3):n(H2O2):n(FeCl3):n(K2Cr2O7)= : : : .(要求写出最简比)
查看答案和解析>>
科目: 来源:2011-2012学年浙江省高三10月份月考化学试卷 题型:填空题
Cu、Cu2O和CuO组成的混合物,加入100mL 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到224mL NO气体(标准状况)。
(1)Cu2O跟稀硝酸反应的离子方程式________。
(2)产物中硝酸铜的物质的量 。
(3)如混合物中含0.01 mol Cu,则含Cu2O mol、含CuO____mol。
查看答案和解析>>
科目: 来源:2011-2012学年浙江省高三10月份月考化学试卷 题型:填空题
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为 。
(2)As2S3和HNO3有如下反应,As2S3+10H++ 10NO3—=2H3AsO4+ 3S+10NO2↑+ 2H2O
若生成2mol H3AsO4,则反应中转移电子的物质的量为 。若将该反应设计成一原电池,则NO2应该在 (填“正极”或“负极”)附近逸出。
(3)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量 (选填编号)。
a.小于0.5 mol b.等于0.5mol c.大于0.5mol d.无法确定
查看答案和解析>>
科目: 来源:2011-2012学年浙江省高三10月份月考化学试卷 题型:实验题
有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。
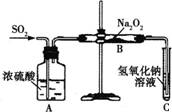
请回答下列问题:
(1) 第一小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是________________________。
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3__________。
(3)设计一种实验方案证明Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否由Na2SO4生成,他们设计了如下方案:

上述方案是否合理?________ (若不合理,请说明理由;若合理,以下不用回答)
①
②
查看答案和解析>>
科目: 来源:2011-2012学年浙江省高三10月份月考化学试卷 题型:实验题
氢化钙固体是登山运动员常用的能源提供剂。某兴趣小组拟选用如下装置制备氢化钙。
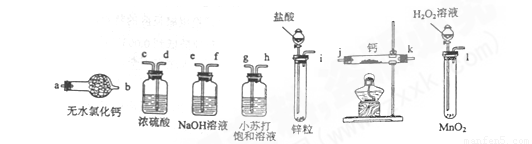
请回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为________(填仪器接口的字母编号)
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞;_________(请按正确的顺序填入下列步骤的标号)。
A.加热反应一段时间 B.收集气体并检验其纯度
C.关闭分液漏斗活塞 D.停止加热,充分冷却
(3)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此判断,上述实验确有CaH2生成。
① 写出CaH2与水反应的化学方程式 ___________________;
②该同学的判断不正确,原因是_________________;
(4)请设计实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现象______。
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是____________。
查看答案和解析>>
科目: 来源:2011-2012学年浙江省高三10月份月考化学试卷 题型:实验题
为探索工业含铝、铁、铜合金废料的再利用,某同学设计的实验方案如下:

请回答:
(1)操作①用到的玻璃仪器有 。
(2)写出反应①的化学方程式 ,
反应②的离子反应方程式 。
(3)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com