
科目: 来源:2011-2012学年浙江省杭州市高三上学期期中七校联考化学试卷 题型:选择题
下列各组物质相互作用,生成物不随反应条件或反应物的用量变化而变化的是
A.Na和O2 B.NaOH和CO2 C.Ca(HCO3)2和Ca(OH)2 D.Na2CO3和HCl
查看答案和解析>>
科目: 来源:2011-2012学年浙江省杭州市高三上学期期中七校联考化学试卷 题型:选择题
下列各组物质中,气体X和气体Y在通常条件下同时通入盛有溶液z的洗气瓶中(如右图所示),可能没有沉淀生成的是

|
|
X |
Y |
Z |
|
A |
NO2 |
SO2 |
BaCl2 |
|
B |
NH3 |
O2 |
Al2(SO4)3 |
|
C |
NH3 |
CO2 |
Ca(OH)2 |
|
D |
NH3 |
CO2 |
CaCl2 |
查看答案和解析>>
科目: 来源:2011-2012学年浙江省杭州市高三上学期期中七校联考化学试卷 题型:选择题
当向蓝色的CuSO4溶液中逐滴加入氨水时,观察到首先生成蓝色沉淀,而后沉淀逐渐溶解成深蓝色溶液,向深蓝色溶液中通入SO2气体,又生成了白色沉淀,将白色沉淀加入稀硫酸中,又生成了红色粉末状固体和SO2,同时溶液呈蓝色。根据实验现象分析推测,下列描述正确的有
A.蓝色沉淀为Cu(OH)2,深蓝色溶液中所含Cu2+浓度较大
B.白色沉淀为+2价铜的某种亚硫酸盐,溶于H2SO4发生复分解
C.白色沉淀为+1价铜的某种亚硫酸盐,在酸性条件下发生了自身的氧化还原反应
D.反应过程中消耗的SO2与生成的SO2的物质的量相等
查看答案和解析>>
科目: 来源:2011-2012学年浙江省杭州市高三上学期期中七校联考化学试卷 题型:选择题
X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如下转化关系(其它产物已略去):下列说法不正确的是
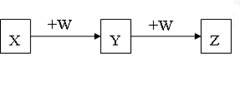
A.若W是氢氧化钠,则X与Z可反应生成Y
B.若W为氧气,则Z与水作用(或溶于水)一定生成一种强酸
C.若X是金属镁,则Z可能是一种常见的还原剂
D.若W是单质铁,则Z溶液可能是FeCl2溶液
查看答案和解析>>
科目: 来源:2011-2012学年浙江省杭州市高三上学期期中七校联考化学试卷 题型:选择题
下图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列反应对应的曲线错误的是
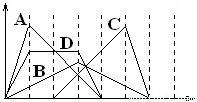
A.向NaAlO2溶液中滴入HCl至过量
B.向澄清石灰水中通入CO2至过量
C.向含有盐酸的A1C13溶液中滴入NaOH溶液至过量
D.向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至沉淀消失
查看答案和解析>>
科目: 来源:2011-2012学年浙江省杭州市高三上学期期中七校联考化学试卷 题型:选择题
如限定使用以下的物质:正盐(钾盐、钠盐、铵盐、钡盐)、酸(盐酸、硝酸、醋酸、稀硫酸)。那么符合离子方程式:2H++ ═SO2↑+H2O的化学反应式共有
═SO2↑+H2O的化学反应式共有
A.6个 B.8个 C.9个 D.12个
查看答案和解析>>
科目: 来源:2011-2012学年浙江省杭州市高三上学期期中七校联考化学试卷 题型:选择题
下图装置或操作正确的是
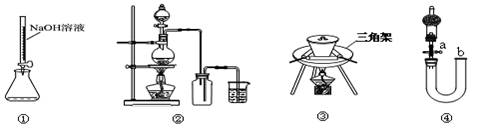
A.用装置①量取15.00ml的NaOH溶液
B.关闭活塞a,从b处加水,以检查装置④的气密性
C.用装置③ 高温煅烧CaCO3固体
D.用装置② 制备Cl2
查看答案和解析>>
科目: 来源:2011-2012学年浙江省杭州市高三上学期期中七校联考化学试卷 题型:选择题
市场上有一种用于预防和治疗缺氧症状的便携式制氧器,利用过碳酸钠固体A(化学式为2Na2CO3·3H2O2)和灰黑色固体B(不溶于水)与水混合反应制得氧气。某同学对A、B两种物质进行探究,实验步骤及现象如下图所示。下列说法错误的是

A. B在反应①中可能起催化作用 B.设计③的目的是制取氧气
C.第②步分离混合物的方法是过滤 D.白色沉淀D为CaCO3
查看答案和解析>>
科目: 来源:2011-2012学年浙江省杭州市高三上学期期中七校联考化学试卷 题型:选择题
高氯酸是很强的酸,沸点是130℃。质量分数为60%的溶液加热不分解,浓度增高就不稳定,受热易分解,热、浓的高氯酸溶液遇有机物爆炸。为使市售的70%高氯酸进一步浓缩,所采取的措施正确的是
A.各仪器连接处必须用磨口玻璃 B.各仪器连接处的橡胶塞应塞紧防止漏气
C.加入生石灰后减压蒸馏 D.加入浓硫酸后常压蒸馏
查看答案和解析>>
科目: 来源:2011-2012学年浙江省杭州市高三上学期期中七校联考化学试卷 题型:填空题
(16分)下表为元素周期表的一部分,请用化学用语回答下列问题:
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
⑦ |
|
⑧ |
⑨ |
|
(1)④、⑤、⑥的原子半径由大到小的顺序为_________________ ___(用元素符号表示)。
(2)请用化学方程式表示非金属性:②>⑦ _______ ____
(3)表中①、④两种元素的原子可按1:1组成一种具有二元弱酸性质的物质,请写出该物质
的电离方程式: 该弱酸性物质与⑤的最高价氧化物对应的水化物反应时可生成一种酸式盐,该酸式盐的电子式:
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

A.X溶液与Y溶液反应的离子方程式为______________ _______,
B.N→⑥的单质的化学方程式为____________ ____。
C.常温下,为了使0.1 mol/L M 溶液中由M电离出的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至_____________ ____。
(5)由④、⑤、⑧三中元素形成的化合物溶液中,加入盐酸发生氧化还原反应的离子方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com