
科目: 来源:2011-2012学年浙江省五校高三第一次联考化学试卷 题型:选择题
已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性。对于浓度均为0.1mol/L的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中正确的是
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
D.两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等
查看答案和解析>>
科目: 来源:2011-2012学年浙江省五校高三第一次联考化学试卷 题型:选择题
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件关于离子共存说法中正确的是
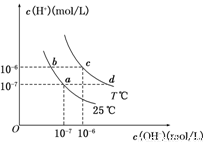
A.a点对应的溶液中大量存在:Fe3+、Na+、Cl-、SO
B.b点对应的溶液中大量存在:NH、Ba2+、OH-、I-
C.c点对应的溶液中大量存在:Na+、Ba2+、Cl-、CO32-
D.d点对应的溶液中大量存在:Na+、K+、SO、Cl—
查看答案和解析>>
科目: 来源:2011-2012学年浙江省五校高三第一次联考化学试卷 题型:选择题
最近科学家研究发现,人的体香体味中存在两种名为“AND”和“EST”的荷尔蒙,它们的结构简式如下图所示。已知同一碳原子上连有四个不同的原子或原子团时,这样的碳原子称为手性碳原子。结合以上信息,下列说法正确的是( )
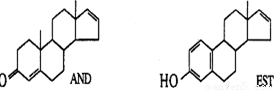
A.这两种分子均包含四个手性碳原子
B.与足量H2反应后产物互为同系物
C.“AND”和“EST”两者分子式之差为CH2
D.“AND”和“EST”分别与足量溴反应时,均消耗3mol。
查看答案和解析>>
科目: 来源:2011-2012学年浙江省五校高三第一次联考化学试卷 题型:选择题
瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(下图甲)能够在煤矿巷道中的甲烷浓度达到一定浓度时,可以通过传感器显示。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如下图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。
 甲
甲  乙
乙
下列有关叙述正确的的是( )
A.瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a
B.电极b是正极,O2-由电极a流向电极b
C.电极a的反应式为:CH4+5O2—―8e-=CO32- +2H2O
D.当固体电解质中有1 mol O2-通过时,电子转移4 mol
查看答案和解析>>
科目: 来源:2011-2012学年浙江省五校高三第一次联考化学试卷 题型:选择题
把物质的量均为0.1mol的AlCl3、CuCl2和H2SO4溶于水制成100ml的混合溶液,用石墨做电极电解,并收集两电极所产生的气体,一段时间后在两极收集到的气体在相同条件下体积相同。则下列描述正确的是( )
A.电路中共转移0.9mol电子
B.阳极得到的气体中有O2且其物质的量为0.35mol
C.阴极质量增加3.2g
D.铝元素以Al(OH)3的形式存在
查看答案和解析>>
科目: 来源:2011-2012学年浙江省五校高三第一次联考化学试卷 题型:填空题
在CS2溶剂中,加入碘和过量的白磷(P4)反应,只生成四碘化二磷。反应后蒸出CS2,固体物质为四碘化二磷和过量的P4,加入适量水到固体物中反应,生成磷酸和一种碘化物A,A中阳离子为正四面体构型,A中既含有离子键,也有共价键,还有配位键。写出四碘化二磷、P4和水反应的化学方程式________________________________,四碘化二磷的磷的化合价为________,磷酸中磷的化合价为____________________,A中磷的化合价为____________________。
查看答案和解析>>
科目: 来源:2011-2012学年浙江省五校高三第一次联考化学试卷 题型:填空题
Na与S反应可以生成多种产物:Na2S,Na2S2……Na2S5。已知Na2S2的电子式为 则S32-的电子式为
。已知Na2S3+2HCl
= 2NaCl+H2S↑+2S↓,试写出Na2S5与醋酸反应的离子方程式:
。工业上常用电解熔融NaCl制Na,事实上电解许多熔融的钠的化合物也能制备Na,如NaOH、Na2CO3。试写出电解熔融NaOH的反应方程式:
,若电解熔融Na2CO3时有CO2气体产生,则阳极电极反应式为
。
则S32-的电子式为
。已知Na2S3+2HCl
= 2NaCl+H2S↑+2S↓,试写出Na2S5与醋酸反应的离子方程式:
。工业上常用电解熔融NaCl制Na,事实上电解许多熔融的钠的化合物也能制备Na,如NaOH、Na2CO3。试写出电解熔融NaOH的反应方程式:
,若电解熔融Na2CO3时有CO2气体产生,则阳极电极反应式为
。
查看答案和解析>>
科目: 来源:2011-2012学年浙江省五校高三第一次联考化学试卷 题型:填空题
A、B、C、D、E、F、G、L、I九种主族元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E、B与G、D与L分别为同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5,D的最外层电子数是F的2倍,C和D的最外层电子数之和为11。请回答下列问题:
(1)以上八种元素中非金属所形成的最简单气态氢化物稳定性最弱的是(填化学式)_________,E、F、L所形成的简单离子的半径由大到小的顺序为(用离子符号表示)__ __ > > 。
(2)由L、I两元素可按原子个数比1:1组成化合物X,化合物X中各原子均满足8电子的稳定结构,则X的电子式为 。固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为: 。
(3)在10 L的密闭容器中,通入2mol LD2气体和1 mol D2气体,一定温度下反应后生成LD3气体,当反应达到平衡时,D2的浓度为0.01 mol·L-1,同时放出约177 kJ的热量,则平衡时LD2的转化率为 ;该反应的热化学方程式为 ;此时该反应的平衡常数K= 。
(4) 有人设想寻求合适的催化剂和电极材料,以C2、A2为电极反应物,以HCl一NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极反应式 ;放电时溶液中H+移向 (填“正”或“负”)极。
查看答案和解析>>
科目: 来源:2011-2012学年浙江省五校高三第一次联考化学试卷 题型:填空题
(1)在一定体积的密闭容器中,进行如下化学反应,CO2(g)+H2(g) CO(g)+H2O(g)。其化学平衡常数K与温度t的关系如下。请回答下列问题:
CO(g)+H2O(g)。其化学平衡常数K与温度t的关系如下。请回答下列问题:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
①该反应的化学平衡常数的表达式K = ,由上表数据可得,该反应为 反应。(填“吸热”或“放热”)
②800℃,固定容器的密闭容器中,放入混合物,其始浓度为c(CO)=0.01 mol·L-1、c(H2O)=0.03 mol·L-1、c(CO2)=0.01 mol·L-1、c(H2)=0.05 mol·L-1,则反应开始时,H2O的消耗速率比生成速率 (填"大"、"小"或"不能确定")
③830℃,在1 L的固定容器的密闭容器中放入2 mol CO2和1 mol H2,平衡后CO2的转化率为 。
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:

①平衡时CH3OH的体积分数w为 。
②现在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。下列说法正确的是
|
容器 |
实验1 |
实验2 |
实验3 |
|
反应物投入量(始态) |
1mol CO2、3mol H2 |
1mol CH3OH、1mol H2O |
2mol CH3OH、2mol H2O |
|
CH3OH的平衡浓度/mol·L-1 |
C1 |
C2 |
C3 |
|
反应的能量变化 |
放出 x kJ |
吸收y kJ |
吸收z kJ |
|
体系压强/Pa |
P1 |
P2 |
P3 |
|
反应物转化率 |
a1 |
a2 |
a3 |
A.2 C1>C3 B.x+y=49.0 C.2P2< P3
D.(a1+ a3)<1 E.2P1> P3 F.a1= a2
③在一个装有可移动活塞的容器中进行上述反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。反应达到平衡后,测得CH3OH的物质的量为a mol,保持容器内的温度和压强不变,向平衡体系中通入少量的H2,再次达到平衡后,测得CH3OH的物质的量为b mol,请比较a、b的大小
。
CH3OH(g)+H2O(g)。反应达到平衡后,测得CH3OH的物质的量为a mol,保持容器内的温度和压强不变,向平衡体系中通入少量的H2,再次达到平衡后,测得CH3OH的物质的量为b mol,请比较a、b的大小
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com