
科目: 来源:2011-2012学年江西省高三第一次月考化学试卷 题型:实验题
(8分)磷、硫元素的单质和化合物应用广泛。
(1)磷元素的原子结构示意图是____________。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:2Ca3(PO4)2+6SiO2===6CaSiO3+P4O10 10C+P4O10===P4+10CO
每生成1 mol P4时,就有________mol电子发生转移。
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C6H8O6+I2===C6H6O6+2H++2I- 2S2O32-+I2===S4O62-+2I-
在一定体积的某维生素C溶液中加入a mol·L-1 I2溶液V1 mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol·L-1 Na2S2O3溶液V2 mL。该溶液中维生素C的物质的量是__________mol。
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2IO3-+5SO32-+2H+===I2+5SO42-+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
|
|
0.01mol·L-1KIO3酸性溶液(含淀粉)的体积/mL |
0.01mol·L-1 Na2SO3溶液的体积/mL |
H2O的体积/mL |
实验温度 /℃ |
溶液出现蓝色时所需时间/s |
|
实验1 |
5 |
V1 |
35 |
25 |
|
|
实验2 |
5 |
5 |
40 |
25 |
|
|
实验3 |
5 |
5 |
V2 |
0 |
|
该实验的目的是______________________________________________;表中V2=___________mL
II、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。
(5)铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中NH4Cl的作用是
查看答案和解析>>
科目: 来源:2011-2012学年江西省高三第一次月考化学试卷 题型:实验题
(13分)用下图装置可以进行测定SO2转化成SO3的转化率的实验。已知SO3的熔点是16.8℃,沸点是44.8℃。已知发生装置中所涉及反应的化学方程式为:
Na2SO3(s)+ H2SO4(85%)=Na2SO4 + SO2↑+ H2O
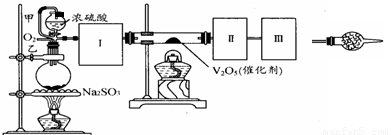
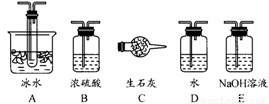
根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ处连接合适的装置。请从下图A~E装置中选择最适合Ⅰ、Ⅱ、Ⅲ处连接的装置分别是 、 、 。
(2)从乙处均匀通入O2,为使SO2有较高的转化率,实验中在加热催化剂与滴加浓硫酸的顺序中,首先应采取的操作是 。
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象不明显,但又不存在气密性问题,请你推测可能的原因并说明相应的验证方法(写2点)。
① 原因 ,验证方法
② 原因 ,验证方法
(4)将SO2通入含1.5mol氯酸的溶液中,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式
(5)用amolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅲ增重了bg,则实验中SO2的转化率为 %(用含a、b的代数式填写)
查看答案和解析>>
科目: 来源:2011-2012学年江西省高三第一次月考化学试卷 题型:填空题
(8分) 雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为 。
(2)上述反应中的氧化剂是 ,反应产生的气体可用 吸收。
(3)As2S3和HNO3有如下反应,As2S3+10H++ 10NO3—=2H3AsO4+ 3S+10NO2↑+ 2H2O
若生成2mol H3AsO4,则反应中转移电子的物质的量为 。若将该反应设计成一原电池,则NO2应该在 (填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量 (选填编号)。
a.小于0.5 mol b.等于0.5mol c.大于0.5mol d.无法确定
查看答案和解析>>
科目: 来源:2011-2012学年江西省高三第一次月考化学试卷 题型:实验题
(7分)蛭石为一种层状结构的含镁的铝硅酸盐,是黑云母等天然矿物风化蚀变的产物,因为其受热膨胀时呈挠曲状,形态酷似水蛭,故此得名蛭石。膨化后的蛭石呈颗粒状,有隔热、耐冻、抗菌、防火、吸声等优异性能,但不耐酸。
(1)某硅酸盐矿石的组成可以看作SiO2中有1/4的Si被Al置换,再由Mg平衡其电荷形成的。该矿石的组成以氧化物形式表示为 。
(2)某校研究性学习小组取得了某种牌号的膨化蛭石样品,其成分可以用氧化物(MgO、Fe2O3、Al2O3、SiO2、H2O)的形式表示。为研究蛭石的组成,拟进行实验探究,实验流程及相关数据如下:
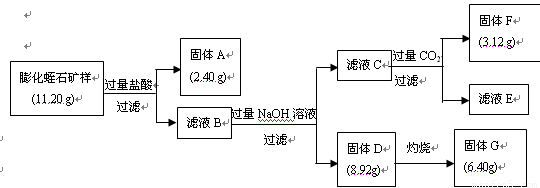
①固体A的化学式是 ;
②固体F的物质的量是 ;
③通过计算,给出用氧化物的形式表示某种膨化蛭石组成的化学式。
查看答案和解析>>
科目: 来源:2011-2012学年江西省红色六校高三第一次联考化学试卷 题型:选择题
化学与生产、生活、社会密切相关,下列有关说法不正确的 ( )
A.多用电子邮件、MSN、QQ等即时通讯工具,少用传真打印机属于“低碳生活”方式
B.我国神七宇航员所穿航天服主要成分是由碳化硅陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料
C.食品保鲜膜、一次性食品袋的主要成分是聚氯乙烯
D.日本福岛核电站爆炸时释放的2种放射性同位素131I与137Cs的中子数不同
查看答案和解析>>
科目: 来源:2011-2012学年江西省红色六校高三第一次联考化学试卷 题型:选择题
通常状况下,NC13是一种油状液体,其分子空间构型与氨分子相似,下列对NC13的有关叙述正确的是 ( )
A.分子中N—C1键键长比CCl4分子中C—C1键键长更长
B.分子中的所有原子均达到8电子稳定结构
C.NCl3分子是非极性分子
D.NBr3比NCl3易挥发
查看答案和解析>>
科目: 来源:2011-2012学年江西省红色六校高三第一次联考化学试卷 题型:选择题
下列反应的离子方程式正确的是 ( )
A.铜片插入氯化铁溶液中: Cu+Fe3+=Cu2++Fe2+
B.电解饱和食盐水: 2Cl-+2H+ H2↑+C12↑
H2↑+C12↑
C.向饱和碳酸氢钙溶液中加入饱和氢氧化钙溶液: Ca2++2HCO3-+2OH-=CaCO3↓+ 2H2O+ CO32-
D.硝酸铝溶液中加过量氨水: A 3++3NH3·H2O
==A
3++3NH3·H2O
==A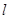 (OH)3↓+3NH4+
(OH)3↓+3NH4+
查看答案和解析>>
科目: 来源:2011-2012学年江西省红色六校高三第一次联考化学试卷 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是 ( )
A.标准状况下,11.2 L的乙烯中含有的共用电子对数为3NA
B.1 mol 明矾与水反应转化为氢氧化铝胶体后,其中胶体粒子的数目为NA
C.1 mol Na2O2晶体中含有阴离子总数为2 NA
D.25℃时,pH=3的1.0LNaHSO3溶液中,含Na+数目为0.001 NA
查看答案和解析>>
科目: 来源:2011-2012学年江西省红色六校高三第一次联考化学试卷 题型:选择题
有Fe2++H++NO3-→Fe3++NH4++H2O这样一个变化过程,下列叙述不正确的是( )
A.氧化剂和还原剂的物质的量之比为1:8
B.该过程说明Fe(NO3)2溶液不宜加酸酸化
C.每1 mol NO3-发生氧化反应,转移8 mol 电子
D.若把该反应设计为原电池,则负极反应为Fe2+- e- = Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com