
科目: 来源:2011-2012学年江苏省无锡市高三上学期期末考试化学试卷 题型:选择题
如右图所示,将两烧杯中电极用导线相连,四个电极分别为Mg、Al、Pt、C。当闭合开关S后,以下表述正确的是( )
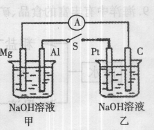
A.电流表指针不发生偏转
B.Al、Pt两极有H2产生
C.甲池pH减小,乙池pH增加
D.Mg、C两极生成的气体在一定条件下可以恰好完全反应
查看答案和解析>>
科目: 来源:2011-2012学年江苏省无锡市高三上学期期末考试化学试卷 题型:选择题
下列说法正确的是 ( )
A.常温下,反应4Fe(OH)2(s)+2H2O(1)+O2(g)=4Fe(OH)3(s)能自发进行,则该反应的△H<0
B.浑浊的苯酚试液中加入饱和Na2CO3溶液变澄清,则酸性:苯酚>碳酸
C.同一可逆反应使用不同的催化剂时,高效催化剂可增大平衡转化率
D.等体积、等物质的量浓度的HA与NaA(ttA为弱酸)混合,所得混合液的酸碱性取决于Ka(HA)的大小
查看答案和解析>>
科目: 来源:2011-2012学年江苏省无锡市高三上学期期末考试化学试卷 题型:选择题
25℃时,下列各溶液中有关物质的量浓度关系不正确的是
A.Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
B.0.1mol·L-1 pH为4的NaHB溶液中:c(HB一)>c(B2-)>c(H2B)
C.NH4HSO4溶液中滴加NaOH至溶液除好呈中性:
c(Na+)>c(SO42-)>c(NH4+)>c(OH一)=c(H+)
D.0.2mol·L-1的某一元弱酸HA溶液和0.1mol·L-1NaOH溶液等体积混合后的溶液:
2c(OH一)+c(A一)=2c(H+)+c(HA)
查看答案和解析>>
科目: 来源:2011-2012学年江苏省无锡市高三上学期期末考试化学试卷 题型:选择题
在温度相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒压,发生反应CH3OCH3(g)+H2O(g)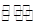 2CH3OH(g);△H=37kJ·mol-1,测得反应达到平衡时的有关数据如下:
2CH3OH(g);△H=37kJ·mol-1,测得反应达到平衡时的有关数据如下:
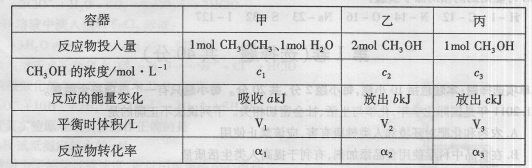
下列说法正确的是 ( )
A.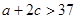 B.
B.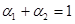 C.V1=2V3 D.
C.V1=2V3 D.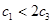
查看答案和解析>>
科目: 来源:2011-2012学年江苏省无锡市高三上学期期末考试化学试卷 题型:填空题
(12分)有关钴、镍和铁化合物的性质见下表:

氯化钴可用于化学反应催化剂,油漆催干剂,干湿指示剂,啤酒泡沫稳定剂,陶瓷着色剂,制造隐显墨水等。用金属钴板(含少量Fe、Ni)制备氯化钴的工艺流程如下:

钴与盐酸反应极慢,需加入催化剂硝酸才可能进行实际生产。
(1)“除镍”步骤中,NH3·H2O用量对反应收率的影响,见下表:
从表中可知x= 时,除镍效果最好。
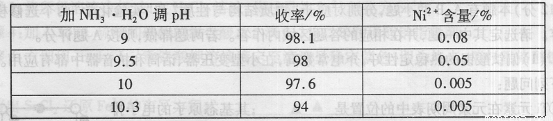
(2)“除镍”步骤必须控制在一定的时间内完成,否则沉淀将有部分Co(OH)3生成,试写出反应的化学方程式 。
(3)“除铁”步骤中加入双氧水发生反应的离子方程式是 .
(4)“除铁”步骤中加入的纯碱作用是 。
(5)在“调pH"步骤中,加盐酸的作用是
(6)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe3++3H2O Fe(OH)3+3H+的平衡常数为
。
Fe(OH)3+3H+的平衡常数为
。
查看答案和解析>>
科目: 来源:2011-2012学年江苏省无锡市高三上学期期末考试化学试卷 题型:填空题
(15分)我国化学家于2007年合成了一种新型除草剂,其合成路线如下。
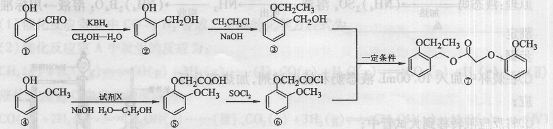
(1)除草剂⑦的分子式为 ,其分子中的含氧官能团有 (写名称,至少写两种)。
(2)③与⑥生成⑦的反应类型是 ,④—⑤转化的另一产物是。HCl,则试剂X是 。
(3)写出同时满足下列条件的物质③的同分异构体的结构简式 (写出一种即可)。
①属于芳香族化合物;②苯环上的一取代物只有两种;③在铜催化下与O2发生反应,其生成物l mol与足量的银氨溶液反应生成4mol Ag
(4)写出②→③的化学方程式 。
(5)卡巴拉丁是老年人认知障碍的重要治疗药物。国外临床试验证明该药物对改善痴呆患者的认知症状及日常活动能力具有一定的作用,且副作用少。请结合上述合成路线及下面所给的反应:
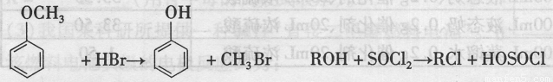
完成以下合成(箭头上写所缺的试剂,方框内写有机物的结构简式):
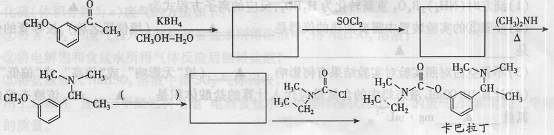
查看答案和解析>>
科目: 来源:2011-2012学年江苏省无锡市高三上学期期末考试化学试卷 题型:填空题
(12分)臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂。
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如6Ag(s)+Os(g)=3Ag2O(s);
△H= 一235.8kJ·mol-1,已知2Ag2O(s)=4Ag(s)+O2(g);△H=+62.2kJ·mol-1,则O3转化为O2的热化学方程式为 。
(2)臭氧在水中易分解,臭氧的浓度减少一半所需的时间如下图所示。

pH增大能加速O3分解,表明对O3分解起催化作用的是 。
(3)电解法臭氧发生器具有臭氧浓度高、成分纯净、在水中溶解度高的优势,在医疗、食品加工与养殖业及家庭方面具有广泛应用前景。科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,其电极反应式为 ;阴极附近的氧气则生成过氧化氢,其电极反应式为 。
(4)为测定大气中臭氧(03)含量,将0℃、1.01 × 105Pa的空气VL慢慢通过足量KI溶液,使臭氧完全反应;然后将所得溶液用amL cmol·L。的Na2S2O2溶液进行滴定恰好到达终点。
①O3与Ⅺ溶液反应生成两种单质,则反应的化学方程式 。
②空气中臭氧的体积分数为 。
(已知:2Na2S2+12=Na2S406+2NaI)
查看答案和解析>>
科目: 来源:2011-2012学年江苏省无锡市高三上学期期末考试化学试卷 题型:填空题
(15分)重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等。工业上以铬铁矿(主要成分FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O)的主要反应如下:
①4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
②2Na2Cr04+H2S04.-----~Na2S04+Na2Cr207+H20
(1)反应①是在回转窑中进行,反应时需不断搅拌,
其目的是 。
(2)右图是红矾钠(Na2Cr2O7·2H2O)和Na2SO4的溶
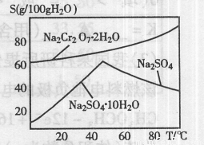
解度曲线。从Na2Cr2O7和Na2SO4的混合溶液中提取Na2Cr2O7,
晶体的操作:先将混合溶液蒸发浓缩,趁热过滤。趁热过滤的目的是 ;然后将滤液 ,从而析出红矾钠。
(3)Na2Cr2O7与KCl或K2SO4进行复分解反应可制取K2Cr2O7,现
用Na2Cr2O7与KCl来制备K2Cr2O7,简述操作步骤(有关物质的溶
解度见右表): 。
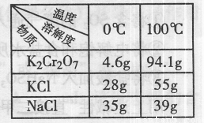
(4)重铬酸钾可用于铁矿石中铁的含量测定,实验步骤如下:
步骤1:将mg铁矿石加浓盐酸加热溶解
步骤2:加入SnCl2溶液将Fe3+还原至黄色消失
步骤3:将所得溶液冷却,加入HgC2溶液,将过量的Sn2+氧化
为Sn4+
步骤4:加人15mL硫酸和磷酸的混合酸及5滴O.2%二苯胺磺酸钠指示剂
步骤5:立即用cmol·L。重铬酸钾溶液滴定至溶液呈稳定紫色,即为终点,消耗重铬酸钾溶液VmL
①写出SnCl2还原Fe3+的离子方程式 。
②如省去步骤③,则所测定的铁的含量 (填“偏高”、“偏低”或“无影响”)。
③步骤5使用的玻璃仪器有
查看答案和解析>>
科目: 来源:2011-2012学年江苏省无锡市高三上学期期末考试化学试卷 题型:填空题
(14分)二甲醚(CH3OCH。)和甲醇(CH3OH)被称为21世纪的新型燃料,具有清洁、高效等优良的性能。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:

(1)催化反应室B中CO与H2合成二甲醚的化学方程式为 .
(2)催化反应室A中发生的反应为:
CH4(g)+H2O(g) CO(g)+3H2(g)……(I)、CO(g)+H2O(g)
CO(g)+3H2(g)……(I)、CO(g)+H2O(g) CO2(g)+H2(g)……(Ⅱ)催化反应室C中发生的反应为:
CO2(g)+H2(g)……(Ⅱ)催化反应室C中发生的反应为:
CO(g)+2H2(g) CH3OH(g)……(Ⅲ)、CO2(g)+3H2(g)
CH3OH(g)……(Ⅲ)、CO2(g)+3H2(g) CH3OH(g)+H2O(g)……(Ⅳ)
CH3OH(g)+H2O(g)……(Ⅳ)
①已知:原子利用率= ×100%,试求反应(Ⅳ)的原子利用率为 。
×100%,试求反应(Ⅳ)的原子利用率为 。
②反应(Ⅳ)的△S 0(填“>”、“=”或“<”)。
③在压强为5MPa,体积为VL的反应室c中,amol CO与20mol H2在催化剂作用下发生反应(Ⅲ)生成甲醇,CO的转化率与温度的关系如右图。则该反应的△H 0(填“>”、“=”或“<”)。300℃时该反应的平衡常数K= (用含字母的代数式表示)。

(3)我国某科研所提供一种碱性“直接二甲醚燃料电池”。
该燃料电池负极的电极反应式为:
CH3OCH3一12e一+16OH一=2CO2-3+11H2O。有人提出了一种利用氯碱工业产品治理含二氧化硫(体积分数为x)废气的方法如下:
①将含SO2的废气通人电解饱和食盐水所得溶液中,得NaHSO3溶液;
②将电解饱和食盐水所得气体反应后制得盐酸;
③将盐酸加入NaHSO3溶液中得SO2气体回收。
用上述碱性“直接二甲醚燃料电池”电解食盐水来处理标准状况下VL的废气,计算消耗二甲醚的质量。
查看答案和解析>>
科目: 来源:2011-2012学年江苏省无锡市高三上学期期末考试化学试卷 题型:填空题
(12分)本题有A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.(1)偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。试回答下列问题:
①Ti元素在元素周期表中的位置是 ;其基态原子的
电子排布式为 。
②偏钛酸钡晶体中晶胞的结构示意图如右图,它的化学式是 ;晶体内与每个“Ti”紧邻的氧原子数为 个。

(2)氰气[(CN)2]无色、剧毒、有苦杏仁味,和卤素单质性质相似。已知氰分子中键与键之间的夹角为180。,并有对称性,其结构式为 ,与CN一互为等电子体的单质的分子式为 。
B.某课题小组同学测量液态奶含氮量的实验过程如下:

步骤:
①在烧杯中加入10.00mL液态奶和辅助试剂,加热
充分反应;
②将反应液转移到大试管中;
③按右图装置用水蒸气将NH3吹出,并用H3BO3溶液吸收(加热装置未画出);
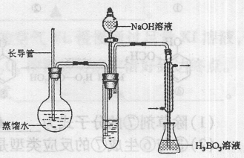
④取下锥形瓶,滴加指示剂,用0.1000mol·L-1盐酸
标准液滴定;
⑤重复测定数次,再用10.00mL蒸馏水代替液态奶进
行上述操作。
数据记录如下:

回答下列问题:
(1)滴定时(NH4)2B4O7重新转化为H3BO3,反应的离子方程式为 。
(2)步骤③的实验装置中需要加热的仪器是 (填仪器名称),长导管的作用是 。
(3)不做空白对照实验对实验结果有何影响 (填“无影响”,或“偏高”,或“偏低”)。
(4)计算10.00mL液态奶中的含氮量应代人计算的盐酸体积是 mL,该液态奶的含氮量 mg·mL-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com