
科目: 来源:2011-2012学年江苏省无锡市高三第二次考试化学试卷 题型:选择题
下列推断或表述正确的是( )
A.因为氯化铝是分子晶体,所以工业制备金属铝不采用电解氯化铝溶液,但工业制取金属镁可以采用电解氯化镁溶液的方法
B.25°C时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体c(Mg2+)增大
C.鸡蛋清中加入2滴1%醋酸铅溶液后会产生沉淀,因为蛋白质发生了变性。
D.在BaSO4悬浊液中加入饱和碳酸钠溶液,过滤、洗涤得固体,再加盐酸产生气体。可证明Ksp(BaSO4)<Ksp(BaCO3)
查看答案和解析>>
科目: 来源:2011-2012学年江苏省无锡市高三第二次考试化学试卷 题型:选择题
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下向10mL 0.01mol·L—1NaHC2O4溶液中滴加0.01mol·L—1NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是( )
A.V(NaOH) = 0时,c(H+)=1×10—2mol·L—1
B.V(NaOH) <10mL时, 可能存在c(Na+)=2c(C2O42-)+c(HC2O4- )
C.V(NaOH) = 10 mL时, c(H+) = 1×10—7mol·L—1
D.V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4- )
查看答案和解析>>
科目: 来源:2011-2012学年江苏省无锡市高三第二次考试化学试卷 题型:选择题
在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100
mol·L-1,c(B)=0.200 mol·L-1 ,c(C)=0 mol·L-1。反应物A的浓度随时间的变化如右图所示。下列说法正确的是
(
)
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100
mol·L-1,c(B)=0.200 mol·L-1 ,c(C)=0 mol·L-1。反应物A的浓度随时间的变化如右图所示。下列说法正确的是
(
)

A.反应A+2B C的△H>0
C的△H>0
B.若反应①、②的平衡常数分别为K1、K2,则K1< K2
C.实验②平衡时B的转化率为60%
D.减小反应③的压强,可以使平衡时c(A)=0.060 mol·L-1
查看答案和解析>>
科目: 来源:2011-2012学年江苏省无锡市高三第二次考试化学试卷 题型:填空题
(16分)硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得。
已知:Na2S2O3在酸性溶液中不能稳定存在。
(1)某研究小组设计了制备Na2S2O3·5H2O装置和部分操作步骤如下。
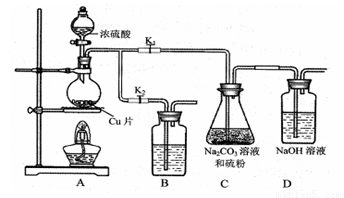
I.打开K1,关闭K2,向圆底烧瓶中加入足量浓硫酸,加热。
II.C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。当C中溶液的pH接近7时即停止C中的反应,停止加热。
III.过滤C中的混合液。
IV.将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品。
①I中,圆底烧瓶中发生反应的化学方程式是 。
②II中,“当C中溶液的pH接近7时即停止C中的反应”的原因是 。
“停止C中的反应”的操作是 。
③III中,“过滤”用到的玻璃仪器是(填仪器名称) 。
④装置B中盛放的试剂是(填化学式) 溶液,其作用是 。
(2)依据反应2S2O32-+I2=S4O62-+2I-,可用I2的标准溶液测定产品的纯度。取5.5g产品,配制成100mL溶液。取10mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol/L I2的标准溶液进行滴定,相关数据记录如下表所示。
|
编号 |
1 |
2 |
3 |
4 |
|
溶液的体积/mL |
10.00 |
10.00 |
10.00 |
10.00 |
|
消耗I2标准溶液的体积/mL |
19.99 |
19.98 |
17.13 |
20.03 |
② 断达到滴定终点的现象是 。
②Na2S2O3·5H2O在产品中的质量分数是(计算结果保留1位小数) 。
查看答案和解析>>
科目: 来源:2011-2012学年江苏省无锡市高三第二次考试化学试卷 题型:填空题
(15分)氢氧化镁用于制药工业,还是重要的绿色阻燃剂。
Ⅰ.治疗胃酸过多药物Stmoache的有效成分为Mg(OH)2。
(1)该药物治疗胃酸(主要成分为盐酸)过多症时反应的离子式方程式为 ;
Ⅱ.已知:
H2O(g)=H2(g)+  O2(g)
△H1 = +242 kJ·mol-1
O2(g)
△H1 = +242 kJ·mol-1
Mg(s)+2 H2O(g)=Mg(OH)2(s) + H2(g) △H2 = -441 kJ·mol-1
Mg(s)+  O2(g)=MgO(s)
△H3
= -602kJ·mol-1
O2(g)=MgO(s)
△H3
= -602kJ·mol-1
(2)氢氧化镁分解的热化学方程式为 ;
Ⅲ.某工厂用六水合氯化镁和粗石灰制取的氢氧化镁含有少量氢氧化铁杂质,通过如下流程进行提纯精制.获得阻燃剂氢氧化镁。

(3)步骤①中加入保险粉 的作用:
。
的作用:
。
(4)已知EDTA只能与溶液中的 反应生成易溶于水的物质,不与
反应生成易溶于水的物质,不与 反应。虽然
反应。虽然 难溶于水,但步骤②中随着EDTA的加入,最终能够将
难溶于水,但步骤②中随着EDTA的加入,最终能够将 除去并获得纯度高的
除去并获得纯度高的 。请从沉淀溶解平衡的角度加以解释
;
。请从沉淀溶解平衡的角度加以解释
;
Ⅳ.为研究不同分离提纯条件下所制得阻燃剂的纯度从而确定最佳提纯条件,某研究小组各取等质量的下列4组条件下制得的阻燃剂进行含铁量的测定,结果如下:
|
精制阻燃剂的条件 |
阻燃剂铁含量 |
|||
|
序号 |
提纯体系温度/℃ |
加入EDTA质量/g |
加入保险粉质量/g |
W(Fe)/(10-4g) |
|
1 |
40 |
0.05 |
0.05 |
7.63 |
|
2 |
40 |
0.05 |
0.10 |
6.83 |
|
3 |
60 |
0.05 |
0.10 |
6.83 |
|
4 |
60 |
0.10 |
0.10 |
6.51 |
(5)若不考虑其它条件,根据上表数据,制取高纯度阻燃剂最佳条件是 (填字母)。
①40℃ ②60℃ ③EDTA质量为O.05g
④EDTA质量为0.10g ⑤保险粉质量为0.05g ⑥保险粉质量为0.10g
A.①③⑤ B.②④⑥ C.①④⑥ D.②③⑤
查看答案和解析>>
科目: 来源:2011-2012学年江苏省无锡市高三第二次考试化学试卷 题型:填空题
(15分)非金属元素氮有多种氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构式分别是 和
和 。实验测得N-N键键能为167kJ·mol-1,NO2中氮氧双键的平均键能为466 kJ·mol-1,N2O4中氮氧双键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能为167kJ·mol-1,NO2中氮氧双键的平均键能为466 kJ·mol-1,N2O4中氮氧双键的平均键能为438.5 kJ·mol-1。
(1)写出NO2转化为N2O4的热化学方程式_________________________________________
(2)对反应2NO2
(g) N2O4 (g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是(
)
N2O4 (g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是(
)

A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.400mol的NO2气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
|
时间(s) |
0 |
20 |
40 |
60 |
80 |
|
n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
|
n(N2O4)/mol |
0.00 |
0.05 |
n2 |
0.08 |
0.08 |
①在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为___ __。
②2NO2(g) N2O4(g)该反应的平衡常数K的值为
;若100℃时的某时刻测得c(NO2)=1.00mol/L,c(N2O4)=0.20mol/L,则该时刻的v正 v逆(填“>”、“<”或“=”),升高温度后,反应2NO2
N2O4(g)该反应的平衡常数K的值为
;若100℃时的某时刻测得c(NO2)=1.00mol/L,c(N2O4)=0.20mol/L,则该时刻的v正 v逆(填“>”、“<”或“=”),升高温度后,反应2NO2 N2O4的平衡常数K将
(填“增大”、“减小”或“不变”)。
N2O4的平衡常数K将
(填“增大”、“减小”或“不变”)。
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是_____________mol·L-1。
④计算③中条件下达到平衡后混合气体的平均相对分子质量为____________。(结果保留小数点后一位)
查看答案和解析>>
科目: 来源:2011-2012学年江苏省无锡市高三第二次考试化学试卷 题型:填空题
(10分)工业上以锂辉石(Li2O·A12O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:

已知:① Li2O·Al2O3·4SiO2 +H2SO4(浓) Li2SO4+Al2O3·4SiO2·H2O↓
② 某些物质的溶解度(S)如下表所示。
|
T/℃ |
20 |
40 |
60 |
80 |
|
S(Li2CO3)/g |
1.33 |
1.17 |
1.01 |
0.85 |
|
S(Li2SO4)/g |
34.2 |
32.8 |
31.9 |
30.7 |
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。则步骤Ⅱ中反应的离子方程式是 。
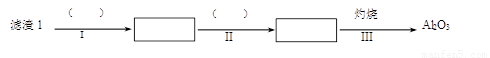
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。
向滤液1中加入石灰乳的作用是(运用化学平衡移动原理解释) 。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是
。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
① a中,阳极的电极反应式是 。
② b中,生成Li2CO3反应的化学方程式是 。
查看答案和解析>>
科目: 来源:2011-2012学年江苏省无锡市高三第二次考试化学试卷 题型:填空题
(12分)以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如下表。
|
难溶物 |
Ksp |
|
Ca3(AsO4)2 |
6.8×10-19 |
|
AlAsO4 |
1.6×10-16 |
|
FeAsO4 |
5.7×10-21 |
|
污染物 |
H2SO4 |
As |
|
浓度 |
28.42 g/L |
1.6 g·L-1 |
|
排放标准 |
pH 6~9 |
0.5 mg·L-1 |
表1.几种砷酸盐的Ksp 表2.工厂污染物排放浓度及允许排放标准
回答以下问题:
⑴该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)= mol·L-1。
⑵写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]= ,若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol·L-1,c(AsO43-)最大的是 mol·L-1。
⑶工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式 。
⑷在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为 ;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为 。
查看答案和解析>>
科目: 来源:2011-2012学年江苏省无锡市高三第二次考试化学试卷 题型:填空题
(12分) “物质结构与性质”
(1)第ⅢA、ⅤA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。Ga原子的电子排布式为 。在GaN晶体中,与同一个Ga原子相连的N原子构成的空间构型为 。在四大晶体类型中,GaN属于 晶体。
(2)铜、铁元素能形成多种配合物。微粒间形成配位键的条件是:一方是能够提供孤电子对的原子或离子,另一方是具有 的原子或离子

(3)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:请回答下列问题:
① H、N、O三种元素的电负性由大到小的顺序是 。
②SO2分子的空间构型为 。与SnCl4互为等电子体的一种离子的化学式为 。
③乙二胺分子中氮原子轨道的杂化类型为 。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是 。
④⑶中所形成的配离子中含有的化学键类型有 。
a.配位键 b.极性键 c.离子键 d.非极性键
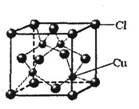
⑤CuCl的晶胞结构如右图所示,其中Cl原子的配位数为 。
查看答案和解析>>
科目: 来源:2011-2012学年江苏省无锡市高三上学期期末考试化学试卷 题型:选择题
2011年是国际化学年,化学与生活、社会密切相关。下列说法不正确的( )
A.农药和化肥对环境和人类健康有害,应该禁止使用
B.在食品中科学使用食品添加剂,有利于提高人类生活质量
C.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
D.积极开发废电池的综合利用技术,能防止电池中的重金属等污染土壤和水体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com