
科目: 来源:2011-2012学年江苏省高三上学期期中考试化学试卷 题型:选择题
常温下,下列各组离子在指定溶液中可能大量共存的是
A.由水电离的c(H+)=10-12mol·L-1的溶液中:Cl-、CO32-、K+、SO32-
B.含有大量AlO2-的溶液中:K+、Al3+、Br-、HCO3-
C.1.0mol·L-1的KNO3溶液:H+、Fe2+、Cl—、SO42—
D.使pH试纸变深蓝色的溶液中:Cl-、K+、Mg2+、SO32-
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三上学期期中考试化学试卷 题型:选择题
下列说法中正确的是
A.同一可逆反应使用不同的催化剂时,高效催化剂可增大平衡转化率
B.已知反应SO2(g)+H2O(g)=H2SO3(l),该过程熵值增大
C.下图可表示爆炸反应的能量变化曲线

D.同温同压下,H2 (g)+Cl2(g)= 2HCl(g)在光照和点燃条件下的△H不同
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三上学期期中考试化学试卷 题型:选择题
下列实验操作或事实与预期实验目的或所得结论一致的是
|
选项 |
实验操作或事实 |
实验目的或结论 |
|
A |
淡黄色试液 |
说明原溶液中一定含有FeCl3 |
|
B |
Br2 |
制备少量KBr溶液 |
|
C |
无色试液 |
说明原溶液中一定不含钾元素 |
|
D |
H3PO3+2NaOH(足量)=Na2HPO3+2H2O |
H3PO3属于三元酸 |
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三上学期期中考试化学试卷 题型:选择题
X、Y、Z三种短周期元素,原子半径的大小关系为r(Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质在在适当条件下可发生如下变化,其中B和C均为10电子分子。下列说法中不正确的是
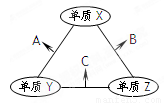
A.X元素位于ⅥA B.B的沸点大于C的沸点
C.A能溶解于B中 D.A和C不可能发生氧化还原反应
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三上学期期中考试化学试卷 题型:选择题
实验用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体经历下列过程,Fe3+在PH=5时已完全沉淀,其分析错误的是

A.用18mol/L浓硫酸配制溶解所用4mol/L的稀硫酸,玻璃仪器一般只有3种;
B.利用Cu(OH)2替代CuO也可调试溶液pH不影响实验结果;
C.洗涤晶体:向滤出晶体的漏斗中加少量水浸没晶体,自然流下,重复2-3次;
D.若要用实验测定所得硫酸铜晶体中结晶水的数目要用到坩埚和坩埚钳。
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三上学期期中考试化学试卷 题型:选择题
关于下列各装置图的叙述中,正确的是
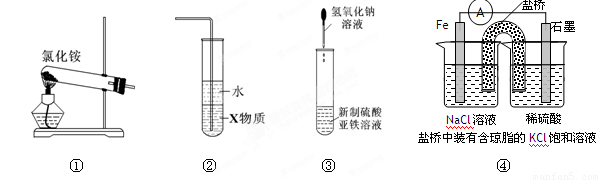
A.实验室用装置①制取氨气
B.装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸
C.装置③可用于制备氢氧化亚铁并观察其颜色
D.装置④左侧烧杯中c(Cl-)增大
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三上学期期中考试化学试卷 题型:选择题
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A
(g)+xB(g)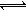 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确是
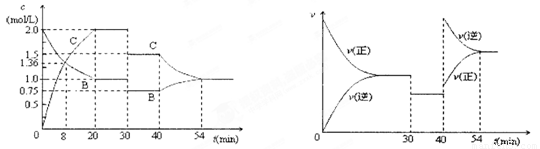
A. 8min时表示正反应速率等于逆反应速率
B.前20min A的反应速率为0.05mol/(L·min )
C.反应方程式中的x=1,30min 时表示增大压强
D.40min时改变的条件是升高温度,且正反应为吸热反应
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三上学期期中考试化学试卷 题型:选择题
下图是一种以烟道气为原料合成乙醇的工作原理示意图。下列说法正确的是
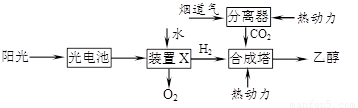
A.该流程图中只存在4种形式的能量转化
B.装置X中阳极反应式为:2H2O-4e-=4H++O2↑
C.合成塔中生成乙醇的反应是化合反应
D.本工艺减轻了烟道气中CO2对环境的压力,绿色化学的成分高
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三上学期期中考试化学试卷 题型:填空题
(12分)饮用水中含有一定浓度的NO3一将对人类健康产生危害,NO3一能氧化人体血红蛋白中的Fe(II),使其失去携氧功能。为了降低饮用水中NO3一的浓度,某兴趣小组提出如下方案:
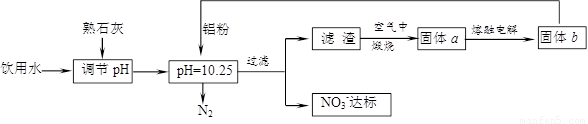
请回答下列问题:
⑴已知过滤后得到的滤渣是一种混合物,则在溶液中铝粉和NO3一反应的离子方程式为
__________________________________________。
⑵该方案中选用熟石灰调节pH,理由是_______________________、__________________,在调节pH时,若pH过大或过小都会造成 的利用率降低。
⑶用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为____________________________________。
⑷饮用水中的NO3- 主要来自于NH4+。已知在微生物作用的条件下,NH4+ 经过两步反应被氧化成NO3- 。两步反应的能量变化示意图如下:
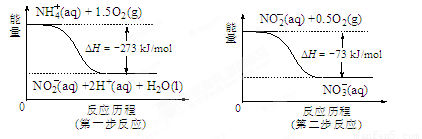
试写出1 mol NH4+ (aq)全部氧化成NO3- (aq)的热化学方程式是 。
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三上学期期中考试化学试卷 题型:填空题
(15分)氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制流程:

根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为 。
(2)混合①中使用冰水的目的是 。
(3)操作Ⅱ和操作Ⅲ的名称分别是 、 。
操作Ⅲ一般适用于分离____________混合物。(选填编号)
a.固体和液体 b.固体和固体 c.互不相溶的液体 d.互溶的液体
(4)混合②中加入Na2SO3的目的是 。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。于是甲乙两同学设计了简单实验加以探究:
甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为 ,若假设成立可观察到的现象为 。
乙同学假设工业氢溴酸呈淡黄色是因为________,其用于证明该假设所用的试剂 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com