
科目: 来源:2011-2012学年江苏省南通市高三上学期期末调研测试化学试卷 题型:填空题
(15分)甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。
⑴工业生产甲醇的常用方法是:CO(g)+2H2(g) CH3OH(g) △H=-90.8 kJ/mol。
CH3OH(g) △H=-90.8 kJ/mol。
已知:2H2(g)+ O2(g)= 2H2O (l) △H=-571.6 kJ/mol
H2(g) + O2(g)
= H2O(g) △H=-241.8 kJ/mol
O2(g)
= H2O(g) △H=-241.8 kJ/mol
①H2的燃烧热为 ▲ kJ/mol。
②CH3OH(g)+O2(g) CO(g)+2H2O(g)的反应热△H= ▲ 。
CO(g)+2H2O(g)的反应热△H= ▲ 。
③若在恒温恒容的容器内进行反应CO(g)+2H2(g) CH3OH(g),则可用来判断该反应达到平衡状态的标志有 ▲ 。(填字母)
CH3OH(g),则可用来判断该反应达到平衡状态的标志有 ▲ 。(填字母)
A.CO百分含量保持不变
B.容器中H2浓度与CO浓度相等
C.容器中混合气体的密度保持不变
D.CO的生成速率与CH3OH的生成速率相等
⑵工业上利用甲醇制备氢气的常用方法有两种:
①甲醇蒸汽重整法。该法中的一个主要反应为CH3OH(g) CO(g)+2H2(g),此反应能自发进行的原因是 ▲ 。
CO(g)+2H2(g),此反应能自发进行的原因是 ▲ 。
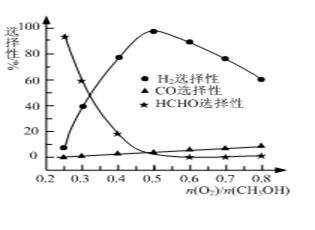
②甲醇部分氧化法。在一定温度下以Ag/CeO2—ZnO为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图所示。则当n(O2)/n(CH3OH)=0.25时,CH3OH与O2发生的主要反应方程式为 ▲ ;在制备H2时最好控制n(O2)/n(CH3OH)= ▲ 。
⑶在稀硫酸介质中,甲醇燃料电池负极发生的电极反应式为 ▲ 。
查看答案和解析>>
科目: 来源:2011-2012学年江苏省南通市高三上学期期末调研测试化学试卷 题型:填空题
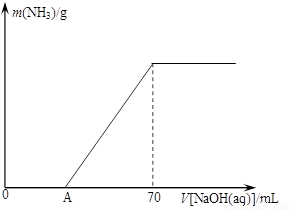
(12分)某氮肥NH4HCO3中混有少量(NH4)2CO3,现采用下列方案测定该氮肥中(NH4)2CO3的质量分数:称取5.7 g上述样品与2.0 mol/L NaOH溶液混合,完全溶解后,低温加热使其充分反应(该温度下铵盐不分解),并使生成的氨气全部被硫酸吸收,测得氨气的质量与所用NaOH溶液体积的关系如图所示:
请回答下列问题:
⑴A点前样品与NaOH反应的离子方程式为 ▲ 。
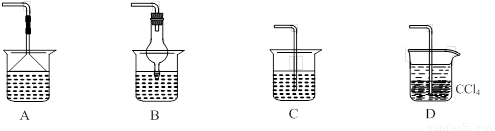
⑵为使生成的氨气被硫酸吸收时不发生倒吸,可以选用下列装置中的 ▲ 。
⑶样品中(NH4)2CO3的质量分数是 ▲ %(保留一位小数)。
⑷当V[NaOH(aq)]=50 mL时,生成NH3的质量为 ▲ 。
查看答案和解析>>
科目: 来源:2011-2012学年江苏省南通市高三上学期期末调研测试化学试卷 题型:实验题
(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.尿素(H2NCONH2)可用于制有机铁肥,主要代表有 [Fe(H2NCONH2)6](NO3)3 [三硝酸六尿素合铁(Ⅲ)]。
⑴基态Fe3+的核外电子排布式为 ▲ 。C、N、O三种元素的第一电离能由大到小的顺序是 ▲ 。
⑵尿素分子中C、N原子的杂化方式分别是 ▲ 。
⑶[Fe(H2NCONH2)6](NO3)3中“H2NCONH2”与Fe(Ⅲ)之间的作用力是 ▲ 。与NO3—互为等电子体的一种化合物是 ▲ (写化学式)。
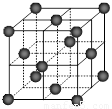
⑷CO2和NH3是工业上制备尿素的重要原料,固态CO2(干冰)的晶胞结构如右图所示。
② 1个CO2分子周围等距离且距离最近的CO2分子有 ▲ 个。
②铜金合金的晶胞结构与干冰相似,若顶点为Au、面心为Cu,则铜金合金晶体中Au与Cu原子数之比为是 ▲ 。
B.脱氢醋酸是一种难溶于水的低毒、高效广谱抗菌剂,可由乙酰乙酸乙酯经脱醇缩合而成,反应原理为:

实验步骤如下:
①在反应器中加入乙酰乙酸乙酯、少量催化剂和数粒沸石,在瓶口安装分馏装置。
②低温加热(不超过85℃)60~70min;然后大火加热蒸出乙醇。
③将反应液趁热倒入烧杯中,冷却到室温,有柠檬黄色晶体析出。
④将柠檬黄色晶体转移至圆底烧瓶B中,加水15mL,滴入1滴硫酸,进行水蒸气蒸馏(如图所示)。从水蒸气蒸馏液中经抽滤可分离出脱氢醋酸,再烘干即得成品。
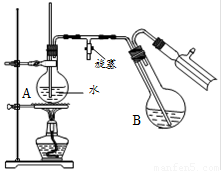
步骤①中加入沸石的目的是 ▲ 。
步骤②中,在60~70min内低温加热的目的是 ▲ ,然后大火加热蒸出乙醇的目的是 ▲ 。
步骤④中水蒸气蒸馏装置中烧瓶A的作用是 ▲ ,玻璃管的作用是 ▲ 。
用测得相对分子质量的方法,可以检验所得产物是否纯净,测得相对分子质量通常采用的仪器是 ▲ 。
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三上学期期中考试化学试卷 题型:选择题
化学已经渗透到人类生活的各个方面,下列说法不正确的是。
A. 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能消毒杀菌又能净水。
B. “光化学烟雾”、“臭氧空洞”、“硝酸酸雨”的形成都与氮氧化合物有关
C. 低碳生活注重节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放
D. 高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路”。
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三上学期期中考试化学试卷 题型:选择题
下列有关化学用语表示错误的是
A.原子核内有10个中子的氧离子: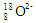
B.鸟粪石中2种阳离子的电子式分别为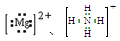
C.氧与氟形成的化合物OF2中,氧元素的化合价为+2价
D.在Mg18O晶体中,阴离子结构示意图可表示为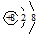
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三上学期期中考试化学试卷 题型:选择题
LiAlH4(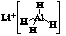 )、LiH既是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125 ℃分解为LiH、H2和Al。下列说法不正确的是
)、LiH既是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125 ℃分解为LiH、H2和Al。下列说法不正确的是
A.LiH与D2O反应,所得氢气的摩尔质量为4 g/mol
B.1 mol LiAlH4在125 ℃完全分解,转移3 mol电子
C.LiAlH4溶于适量水得到无色溶液,则化学方程式可表示为:LiAlH4+2H2O===LiAlO2+4H2↑
D.LiAlH4与乙醛作用生成乙醇,LiAlH4作还原剂
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三上学期期中考试化学试卷 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.向含有Fe2O3悬浊液中通入HI: Fe2O3 + 6H+ = 2Fe3+ + 3H2O
B.少量SO2气体通入NaClO溶液中:SO2+H2O+ClO- =SO42-+Cl-+2H+
C.误将洁厕灵与消毒液混合: H++Cl-+HClO=Cl2↑+H2O
D.将1 mol/L NaAlO2溶液和1.5 mol/L HCl溶液等体积互相均匀混合:
6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三上学期期中考试化学试卷 题型:选择题
已知NA代表阿伏加德罗常数,下列说法正确的是
A. 34 g H2O2中含有的阴离子数为NA
B. 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA
C. 1mol重甲基(-CD3)含有电子数为9NA
D. 1 mol铁铝混合物与足量稀盐酸反应时,转移电子数是3NA
查看答案和解析>>
科目: 来源:2011-2012学年江苏省高三上学期期中考试化学试卷 题型:选择题
下列说法中正确的是
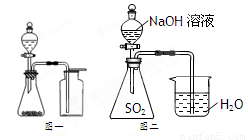
A.氯气通入澄清石灰水中,制取漂粉精
B.可用化合反应的方法制取Fe(OH)3
C.选择合适的试剂,用图一所示装置可分别制取少量CO2、NO和O2
D.图二装置证明SO2与NaOH发生了反应(系统装置不漏气)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com