
科目: 来源:2011-2012学年安徽省高三第一学期期中考试化学试卷 题型:选择题
根据下图海水综合利用的工业流程图,判断下列说法正确的是 ( )
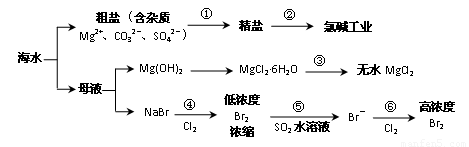
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
A.过程①的提纯是物理过程,过程②通过氧化还原反应可产生1种单质
B.在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2
C.在过程④、⑥反应中每氧化0.2 mol Br- 需消耗2. 24 L Cl2
D.过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
查看答案和解析>>
科目: 来源:2011-2012学年安徽省高三第一学期期中考试化学试卷 题型:选择题
在含有硝酸铜、硝酸铁、硝酸银各0.1 mol的混合溶液中加入铁粉,充分反应后,析出3.2 g铜,则向溶液中加入的铁粉质量为 ( )
A.5.6 g B.2.8 g C.8.4g D.14 g
查看答案和解析>>
科目: 来源:2011-2012学年安徽省高三第一学期期中考试化学试卷 题型:选择题
向一定量的Fe、FeO和Fe2O3的混合物中加入120 mL 4 mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344 L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为 ( )
A.0.24 mol B.0.21 mol C.0.16 mol D.0.14 mol
查看答案和解析>>
科目: 来源:2011-2012学年安徽省高三第一学期期中考试化学试卷 题型:填空题
(12分,每空2分) 现有A、B、C、D、E、F六种常见化合物,已知它们:阳离子分别有K+、Ag+、Na+、Ba2+、Fe2+、Al3+;阴离子分别有Cl-、OH-、AlO、NO、SO、CO。将它们分别配成0.1 mol/L的溶液进行如下实验:
①测得溶液A、C、E均呈碱性,且碱性:A>E>C,E的焰色呈浅紫色(透过蓝色钴玻璃观察);
②向B溶液中滴加稀氨水至过量,先生成沉淀,后沉淀全部溶解;
③向F溶液中滴加稀硝酸,溶液变成棕黄色,且有无色气体生成;
④向D溶液中滴加Ba(NO3)2溶液无明显现象。
(1)写出A、D、E、F的化学式:
A__________________;
D__________________;
E__________________;
F__________________。
(2)用离子方程式解释C溶液的碱性:________________________________________。
(3)写出实验③中反应的离子方程式:_________________________________________。
查看答案和解析>>
科目: 来源:2011-2012学年安徽省高三第一学期期中考试化学试卷 题型:填空题
(14分,每空2分)
硫酸亚铁容易被氧化,而硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O]较稳定,常用于代替硫酸亚铁作还原剂。现以铁屑为主要原料制备硫酸亚铁铵晶体,其反应如下:Fe+H2SO4(稀) FeSO4+H2↑
FeSO4+(NH4)2SO4+6H2O
(NH4)2SO4·FeSO4·6H2O
步骤l:在盛有适量铁屑的锥形瓶里加入某种试剂除去油污,加热,充分反应后过滤、
洗涤、干燥、称量,铁屑质量为 。
。
步骤2:将处理过的铁屑加入到一定量的稀H2SO4中,加热至50℃—80℃充分反应,
趁热过滤并用少量热水洗涤,滤液及洗涤液都转移至蒸发皿中。滤渣干燥后称重,剩余铁屑质量为 。
。
步骤3:准确称取所需质量的硫酸铵晶体加入“步骤2”的蒸发皿中,搅拌使之溶解,
缓缓加热一段时间,将其冷却结晶、过滤。用无水乙醇洗涤晶体并自然干燥,称量所得晶体质量为 。
。
回答下列问题:
(1)能够用于除去铁屑表面油污的试剂是 (填字母)。
A.纯碱溶液 B.烧碱溶液 C.明矾溶液 D.稀硫酸
(2)步骤2中趁热过滤的目的是 。
(3)硫酸亚铁在潮湿的空气中易被氧化生成一种物质(碱式硫酸铁),该反应的化学方程式为 。
(4)铁屑表面常有少量的铁锈(Fe2O3· H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答)
。[来源:Zxxk.Com]
H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答)
。[来源:Zxxk.Com]
(5)若忽略铁锈的影响,上述实验中硫酸亚铁铵晶体的产率为 。
(6)请设计一个简单的实验,检验硫酸亚铁铵晶体中含有结晶水(简述实验操作、现象和结论) 。
查看答案和解析>>
科目: 来源:2011-2012学年安徽省高三第一学期期中考试化学试卷 题型:实验题
(14分,每空2分)某试剂厂用银(含杂质铜)和硝酸(含Fe3+)反应制取硝酸银,步骤如下: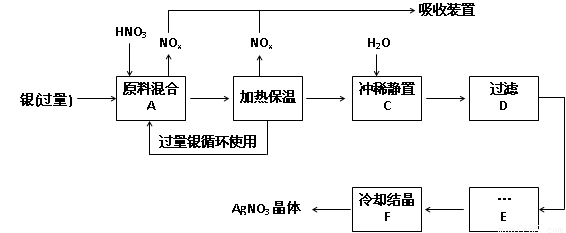
(1)工业上一般选用中等浓度的硝酸和银反应来制取硝酸银。请在下表空格处填空。
|
|
优点 |
缺点 |
|
使用浓硝酸 |
反应速率快 |
酸耗较大,产生NOx的量较多 |
|
使用稀硝酸 |
|
|
(2)步骤B加热保温的作用是 :
a. 有利于加快反应速率
b.有利于未反应的硝酸挥发
c.有利于硝酸充分反应,降低溶液中H+的浓度
(3)步骤C是为了除去Fe3+、Cu2+等杂质,冲稀时产生沉淀的原因是 ;
(4)步骤C中加水的量应该适量,若加入过多的水,对后续步骤造成的不良影响是:
;
(5)步骤E进行的操作是 。
(6)制得的硝酸银中含有少量硝酸铜,通常除去硝酸铜的方法是在步骤E之前加适量新制的Ag2O,使Cu2+转化为Cu(OH)2沉淀,反应后过滤除去。该反应的化学方程式为: 。
查看答案和解析>>
科目: 来源:2011-2012学年安徽省高三第一学期期中考试化学试卷 题型:实验题
(12分) 三硅酸镁为白色无味粉末,不溶于水和乙醇,易与无机酸反应.有关部门规定三硅酸镁样品中含水量不超过12.2%为优良级.某化学兴趣小组欲测定三硅酸镁的化学式(可用MgxSi3Oy·mH2O表示),实验步骤如下:
步骤一:取16.6 g三硅酸镁样品,充分加热至不再分解,冷却、称量,得固体13.0 g.
步骤二:另取16.6 g三硅酸镁样品,向其中加入足量100 mL 4mol/L的盐酸,充分反应后,过滤、洗涤、灼烧,得固体9.0 g.该固体为空间网状结构,且熔沸点很高.
(1)通过计算确定MgxSi3Oy·mH2O的化学式.
(2)该小组测定的三硅酸镁样品是否为优良级?
(3)写出该三硅酸镁样品与盐酸反应的化学方程式.
查看答案和解析>>
科目: 来源:2011-2012学年安徽省高三上学期期中考试化学试卷 题型:选择题
分类法在化学的发展中起到了重要作用,下列有关分类标准的叙述合理的是
A.根据氧化物的组成将氧化物分为酸性氧化物、碱性氧化物和两性氧化物
B.根据化学反应中的热效应将化学反应分为放热反应和吸热反应
C.根据水溶液能否导电将化合物分为电解质和非电解质
D.根据分散质和分散剂的聚集状态将分散系为浊液、胶体和溶液
查看答案和解析>>
科目: 来源:2011-2012学年安徽省高三上学期期中考试化学试卷 题型:选择题
下列有关物质的分类或归类正确的是
① 混合物:石炭酸、福尔马林、水玻璃、水银
② 化合物:CaCl2、烧碱、聚苯乙烯、HD
③ 电解质:明矾、胆矾、冰醋酸、硫酸钡
④ 同素异形体:C60、C70、金刚石、石墨
A.①③ B.②③ C.②④ D.③④
查看答案和解析>>
科目: 来源:2011-2012学年安徽省高三上学期期中考试化学试卷 题型:选择题
下列做法中用到物质氧化性的是
A.臭氧消毒餐具 B.纯碱除去油污
C.食醋清洗水垢 D.明矾净化水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com