
科目: 来源:2011-2012学年上海市十校高三第二次联考化学试卷 题型:选择题
从下列事实所得出的相应结论正确的是……………………………( )
|
|
实 验 事 实 |
结 论 |
|
A |
Cl2的水溶液可以导电 |
Cl2是电解质 |
|
B |
将燃烧的镁条放入CO2中能继续燃烧 |
还原性:Mg>C |
|
C |
将Na2CO3溶液与苯酚浊液混合溶液变澄清 |
酸性:苯酚>HCO3- |
|
D |
常温下白磷可自燃而氮气须在放电时才与氧气反应 |
非金属性:P>N |
查看答案和解析>>
科目: 来源:2011-2012学年上海市十校高三第二次联考化学试卷 题型:选择题
两种一元碱MOH和ROH的溶液分别加水稀释,溶液pH的变化如图所示,下列叙述不正确的是…………………………………………………………………( )
A、MOH是一种弱碱
B、在x点,c(M+)=c(R+)
C、稀释前,c(ROH)=10 c(MOH)
D、稀释前MOH溶液和ROH溶液中由水电离出的c(OH-) 后者是前者的 10倍
查看答案和解析>>
科目: 来源:2011-2012学年上海市十校高三第二次联考化学试卷 题型:选择题
某二元酸(化学式H2A)在水中的电离方程式是H2A→ H+ + HA-、HA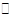 H++A2-又知0.1 mol/L NaHA溶液的pH = 2。则下列说法不正确的是…………………(
)
H++A2-又知0.1 mol/L NaHA溶液的pH = 2。则下列说法不正确的是…………………(
)
A、因为A2-+H2O  HA-+OH-,所以Na2A溶液显碱性
HA-+OH-,所以Na2A溶液显碱性
B、0.1 mol/L H2A溶液中氢离子的物质的量浓度为0.11 mol/L
C、NaHA溶液中各种离子浓度的关系是c(Na+ ) > c(HA-) > c(H+) > c(A2-) > c(OH- )
D、在NaHA溶液中,HA-电离的趋势大于其水解的趋势
查看答案和解析>>
科目: 来源:2011-2012学年上海市十校高三第二次联考化学试卷 题型:选择题
把一定量的Na2O2和NaHCO3混合粉末分为两等份,将其中一份加入到100mL稀盐酸中恰好完全反应,生成干燥的气体2.24L(标准状况),再将此气体通入到另一份混合物中,充分反应后,气体减少为2.016L(标准状况),则原混合粉末中Na2O2和NaHCO3的物质的量之比及原稀盐酸的物质的量浓度可能是…………………………… ( )
|
|
A |
B |
C |
D |
|
Na2O2和NaHCO3的物质的量之比 |
8:1 |
9:2 |
1:8 |
2:9 |
|
原稀盐酸的物质的量浓度(mol/L) |
3.4 |
1.1 |
1.8 |
1.3 |
查看答案和解析>>
科目: 来源:2011-2012学年上海市十校高三第二次联考化学试卷 题型:填空题
某反应池中,发生“生物硝化过程”,利用O2将NH4+氧化成NO3-,如果不考虑过程中硝化细菌的增殖,其净反应如下式所示:

1、完成上述反应的离子方程式并配平,将系数填入方框中,并标出电子的转移方向和数目。
2、反应中,还原剂是 ,被还原的元素是 。
3、将铵态氮中的lmg氮转化成硝酸根中的氮,需氧气 mg。(精确到0.01)
4、取100mL完全反应以后的溶液,加入19.2g铜粉及一定量的稀硫酸,恰好完全反应(假设还原产物全部是NO气体),则原溶液中NH4+的浓度为 mol/L。(假设反应前后溶液的体积不变)
查看答案和解析>>
科目: 来源:2011-2012学年上海市十校高三第二次联考化学试卷 题型:填空题
X、Y、Z、W是短周期的四种元素,有关它们的信息如下表所示。
|
元素 |
部分结构知识 |
部分性质 |
|
X |
X的单质由双原子分子构成,分子中有14个电子 |
X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
|
Y |
Y原子的次外层电子数等于最外层电子数的一半 |
Y能形成多种气态氢化物 |
|
Z |
Z原子的最外层电子数多于4 |
Z元素的最高正化合价与最低负化合价代数和等于6 |
|
W |
W原子的最外层电子数等于2n-3(n为原子核外电子层数) |
化学反应中W原子易失去最外层电子形成Wn+ |
填写下列空白:(提示:不能用字母X、Y、Z、W作答)
1、X单质分子的结构式是 ,Z元素原子最外层共有_____种不同运动状态的电子。
2、X、Y、Z三元素的最高价氧化物的水化物酸性由强到弱的顺序是 。
3、常温时,W的硫酸盐溶液的pH 7(填“=”、“>”或“<”),理由是:
(用离子方程式表示)。
4、25℃、101 kPa时,32 g Y的最低价气态氢化物完全燃烧生成稳定的氧化物时放出1780.6 kJ的热量,写出该反应的热化学方程式 。
查看答案和解析>>
科目: 来源:2011-2012学年上海市十校高三第二次联考化学试卷 题型:填空题
在容积为2.0 L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如右图,据图回答下列问题:
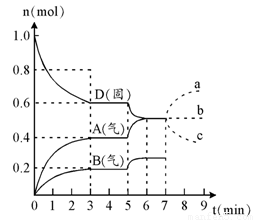
1、从反应开始到第一次达到平衡时,A物质的平均反应速率为 mol/L·min。
2、根据右图写出该反应的化学方程式 ,该反应的平衡常数表达式为K = 。
3、第5分钟时,升高温度,A、B、D的物质的量变化如右图,则该反应的正反应是 (填“放热”或“吸热”)反应,反应的平衡常数 (填“增大”、“减小”或“不变”。下同),B的反应速率 。
4、若在第7分钟时增加D的物质的量,A的物质的量变化正确的是 (用图中a、b、 c的编号回答)
查看答案和解析>>
科目: 来源:2011-2012学年上海市十校高三第二次联考化学试卷 题型:实验题
黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石),为了测定该黄铜矿的纯度,某同学设计了如下实验:

现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的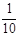 置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,初读数为0.00mL,末读数如右图所示。
置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,初读数为0.00mL,末读数如右图所示。
请回答下列问题:
1、称量样品所用的仪器为 ,将样品研细后再反应,其目的是
。
2、装置a的作用是 。
A、有利于空气中氧气充分反应 b、除去空气中的水蒸气
C、有利于气体混合 d、有利于观察空气流速
3、上述反应结束后,仍需通一段时间的空气,其目的是
。
4、滴定时,标准碘溶液所耗体积为 mL。
判断滴定已达终点的现象是______ 。
5、通过计算可知,该黄铜矿的纯度为 。
6、若用右图装置替代上述实验装置d,同样可以达到实验目的的是 。(填编号)
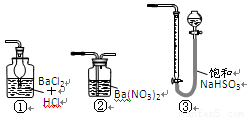
查看答案和解析>>
科目: 来源:2011-2012学年上海市十校高三第二次联考化学试卷 题型:填空题
三聚氰胺(化学式:C3N6H6)是一种非食品类的重要有机化工原料,广泛用于塑料、造纸、建材等行业。下图是我国科技工作者研制的以尿素为原料生产三聚氰胺的工艺——“常压气相一步法联产纯碱新技术”:
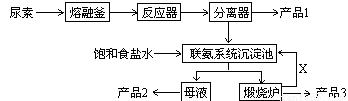
已知:①尿素的熔点是132.7℃,常压下超过160℃即可分解;
②三聚氰胺的熔点是354℃,加热易升华,微溶于水;
③以尿素为原料生产三聚氰胺的原理是:6 CO(NH2)2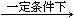 C3N6H6
+6 NH3 + 3 CO2
C3N6H6
+6 NH3 + 3 CO2
请回答:
1、尿素是一种常用含氮量最高的化肥,其氮元素的质量百分数为 ,在实验室使其熔化的容器名称叫_________ 。
2、工业上合成尿素的化学反应方程式为___________________________(反应条件可以不写)
3、写出各主要成份的化学式:产品1 、产品2 、X
4、联氨系统沉淀池中发生的化学反应方程式为: ;
5、为了使母液中析出更多的产品2 ,常用的方法是
A、加入固体NaCl B、加入固体NaHCO3 C、通入CO2气体 D、通入NH3
6、若生产过程中有4%的尿素损耗,每吨尿素可生产三聚氰胺 吨,
副产品纯碱 吨。(精确到0.001)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com