
科目: 来源:2012学年山东省潍坊市高二寒假作业化学试卷(五) 题型:选择题
在醋酸与氢氧化钠溶液的反应完成后,溶液中的相关离子浓度呈现出下列排列顺序:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。满足该条件的反应可能是
A.pH=2的CH3COOH与pH=12的NaOH溶液等体积混合
B.0.1 mol/L的CH3COOH溶液与0.2 mol/L的NaOH溶液等体积混合
C.CH3COOH与NaOH溶液混合后所得溶液的pH=7
D.0.1 mol/L的CH3COOH溶液与等物质的量浓度、等体积的NaOH溶液混合
查看答案和解析>>
科目: 来源:2012学年山东省潍坊市高二寒假作业化学试卷(五) 题型:选择题
已知0.1 mol·L-1的二元酸H2A溶液的pH=4.0,则下列说法正确的是
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
D.在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-)
查看答案和解析>>
科目: 来源:2012学年山东省潍坊市高二寒假作业化学试卷(五) 题型:填空题
(1)在25℃、101kPa下, 1g甲烷完全燃烧生成CO2和液态H2O,放出55 kJ的热量,写出表示甲烷燃烧热的热化学方程式: 。
(2)2Zn(s)+O2(g)=2ZnO(s) ΔH1 = —702 kJ/mol
2Hg(l)+O2(g)=2HgO(s) ΔH2 = —182 kJ/mol
由此可知ZnO(s)+Hg(l)= Zn(s)+HgO(s) △H3= 。
(3)已知 2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的 ΔH=—99kJ·mol-1.请回答下列问题:
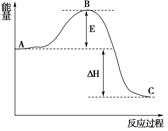
①图中A、C分别表示 、 ,
②E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是
③图中△H= kJ·mol-1。
查看答案和解析>>
科目: 来源:2012学年山东省潍坊市高二寒假作业化学试卷(五) 题型:填空题
已知某溶液中含有4种离子:A+、B一、H+、OH一,对这4种离子浓度的大小比较,有以下3种说法。请判断离子浓度大小顺序是否正确,你认为正确的请在相应的空格内填上符合这种情况的A+和B-组成物质的化学式(只写一种情况,可以是一种溶质,或两种溶质);你认为一定不正确的,请在相应的空格内填上你选择“不正确”的理由。供选择的离子有:Na+、Ag+、NH4+、Cl-、NO3-、CH3COO-、H+、OH-
(1)[B- ]>[A+]>[H+]>[OH- ]:
(2)[A+]>[B- ]>[OH- ]>[H+]:
(3)[H+]>[B- ]>[A+]>[OH- ]:
查看答案和解析>>
科目: 来源:2012学年山东省潍坊市高二寒假作业化学试卷(五) 题型:填空题
830K时,在密闭容器中发生下列可逆反应:
CO(g)+H2O(g) CO2(g)+H2(g) △H<0 试回答下列问题:
CO2(g)+H2(g) △H<0 试回答下列问题:
(1)若起始时c(CO)=2 mol·L-1,c(H2O)=3 mol·L-1,达到平衡时CO的转化率为60%,则在此温度下,该反应的平衡常数K=
(2)在相同温度下,起始物质按下列四种配比充入该容器中,c(H2O)=2mol·L-1 ,c(CO)=c(CO2)=1 mol·L-1, c(H2)=1.5 mol·L-1 ,则此时该反应是否达到平衡状态 (选填“是”与“否”),此时v正 v逆(选填“大于”、“小于”或“等于”)。
(3)平衡时若降低温度,该反应的K值将 (选填“增大”、“减小”或“不变”),平衡 移动(选填“正向”、“逆向”或“不”)。
查看答案和解析>>
科目: 来源:2012学年山东省潍坊市高二寒假作业化学试卷(五) 题型:填空题
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
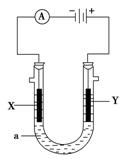
(1)若X、Y都是惰性电极,a是AgNO3溶液,实验开始时,同时在两边各滴入几滴
石蕊试液,则
①电解池中X极上的电极反应式为 ,
②Y电极上的电极反应式为 ,在Y极附近观察到的现象是 。
③电解总反应方程式为 。
(2)如X是金属铁,要在铁件的表面镀铜防止铁被腐蚀,则
①Y电极的材料是 ,电极反应式是 。电解液a选用 溶液。电解过程中其浓度 (增大、减小或不变)
②若电镀前X、Y两电极的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12 g,则电镀时电路中通过的电子为_______mol。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因
。
查看答案和解析>>
科目: 来源:2012学年山东省潍坊市高二寒假作业化学试卷(五) 题型:填空题
某课外活动小组进行电解饱和食盐水的实验(如图)。请同答下列问题。

(1)通电一段时间后,可观察到_______________电极(填
“阴极”或“阳极”)附近溶液颜色先变红,该电极上的电
极反应式为____________。
(2)该溶液电解反应的化学方程式为 。
(3)若开始时改用铁棒做阳极,阳极的电极反应式为 ___________________________________。
(4)若用H2和O2为反应物,以KOH为电解质溶液,可构成新型燃料电池(如下图),两个电极均由多孔性炭制成,通入的气体由孔隙中逸出,并在电极表面放电。其中a是___极(填“正”或“负”),b极的电极反应式为 。

(5)下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是 (填序号)
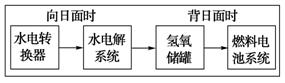
A.该能量转化系统中的水也是可以循环的
B.燃料电池系统产生的能量实际上来自于水
C.燃料电池放电时的正极反应:
H2-2e-+2OH-=2H2O
D.水电解系统中的阳极反应:4OH-―4e-=2H2O+O2↑
查看答案和解析>>
科目: 来源:2012学年山东省潍坊市高二寒假作业化学试卷(五) 题型:填空题
在氯化铜(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下图所示的操作步骤进行提纯.已知在pH为4~5的环境中,Cu2+、Fe2+不生成沉淀,而Fe3+几乎完全沉淀
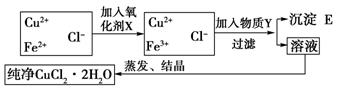
(1)为什么加入氧化剂X?________________
(2)下列物质都可以作为氧化剂,其中最适合于本实验的是
A.H2O2 B.KMnO4 C.NaClO D.K2Cr2O7
(3)物质Y是 ;沉淀E是 。
查看答案和解析>>
科目: 来源:2012学年山东省潍坊市高二寒假作业化学试卷(五) 题型:填空题
(1)有五瓶溶液分别是①10毫升0.60mol/LNaOH水溶液 ②20毫升0.50mol/L硫酸水溶液 ③30毫升0.40mol/LHCl溶液 ④40毫升0.30mol/LCH3COOH水溶液 ⑤50毫升0.20mol/L蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是__________ _。
(2)水的电离平衡如图所示.

①若A点表示25℃时水的电离平衡状态,当升高温度
至100℃时水的电离平衡状态为B点,则此时水的离子积为 。
②将100℃时pH=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为 。
③已知AnBm的离子积=c(Am+)n•c(Bn-)m,若某温度下Ca(OH)2的溶解度为0.74g,其饱
和溶液的密度为1g/mL,其离子积为 。
(3)现有常温下0.1 mol·L—1的纯碱溶液。
①下列纯碱溶液中离子浓度之间的关系正确的是 。
A.c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-)
B.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
C.c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
D.c(CO32-)=c(HCO3-)+c(H2CO3)
②纯碱溶液呈碱性,其原因是(用离子方程式表示) ,
验证纯碱溶液呈碱性的实验方法(简述操作过程): 。
③纯碱溶液与氯化铝溶液混合有大量泡沫生成,其原因是(用离子方程式表示) 。
④某同学认为纯碱溶液中Na2CO3的水解是微弱的,发生水解的CO32-不超过其总量的
10%。请你设计实验证明该同学的观点是否正确。
查看答案和解析>>
科目: 来源:2012学年山东省潍坊市高二寒假作业化学试卷(四) 题型:选择题
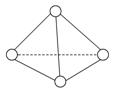
科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如右图所示),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN三N键吸收941kJ热量,则
A.N4的熔点比P4高
B.1molN4气体转化为N2时要吸收724kJ能量
C.N4是N2的同系物
D.1molN4气体转化为N2时要放出724kJ能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com