
科目: 来源:2011年安徽省高一年级化学竞赛试卷 题型:选择题
用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U型管的质量差,实验测得m(H)∶m(O)>1∶8。下列对导致这一结果的原因的分析中,一定错误的是

A.Ⅰ、Ⅱ装置之间缺少干燥装置 B.Ⅲ装置后缺少干燥装置
C.CuO部分被还原成Cu2O D.Ⅱ装置中玻璃管内有水冷凝
查看答案和解析>>
科目: 来源:2011年安徽省高一年级化学竞赛试卷 题型:选择题
已知反应:3BrF3+5H2O=Br2+HBrO3+9HF+O2,若生成标准状况下6.72L O2,则被H2O还原的BrF3的物质的量为
A.0.3mol B.0.4mol C.0.6mol D.0.9mol
查看答案和解析>>
科目: 来源:2011年安徽省高一年级化学竞赛试卷 题型:选择题
美国“海狼”潜艇上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是
A.原子半径:Na>Al
B.铝钠合金若投入一定的水中可得无色溶液,则n(Al)≤n(Na)
C.铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出
D.m g不同组成的铝钠合金投入足量盐酸中,若放出的H2越多,则铝的质量分数越小
查看答案和解析>>
科目: 来源:2011年安徽省高一年级化学竞赛试卷 题型:填空题
(1)I.图表法、图象法是常用的科学研究方法。
短周期某主族元素M的电离能情况如图(A)所示。则M元素位于周期表的第 族。

II.图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可表达第 族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b,你认为正确的是: (填“a”或“b”),理由是: 。
(2).人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测为是钛(22Ti),它被誉为“未来世纪的金属”。试回答下列问题:
I.Ti元素的基态原子的价电子层排布式为 ;
II.在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定;
①偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如图,它的化学式是 ;晶体内与每个“Ti”紧邻的氧原子数为 个。

②已知Ti3+可形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的。则绿色晶体配合物的化学式为 。
查看答案和解析>>
科目: 来源:2011年安徽省高一年级化学竞赛试卷 题型:填空题
A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为 。
(2)由A、B、W三种元素组成的18电子微粒的电子式为 。
(3)经测定A2W2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式 。常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式 。
(4)废印刷电路反上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2W2和衡稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式 。
(5)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,DA能与水反应放氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是 (标准状况下)。
(6)D的某化合物呈淡黄色,可与氯化亚铁溶液反应。若淡黄色固体与氯化亚铁反应的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为
。
查看答案和解析>>
科目: 来源:2011年安徽省高一年级化学竞赛试卷 题型:填空题
电镀广泛地应用于工业生产中。在电镀铬的工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+ Fe3+和Al3+等,且酸性较强。为回收利用铬元索,此工业废水通常采用如下流程处理:
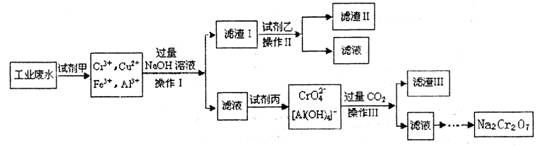
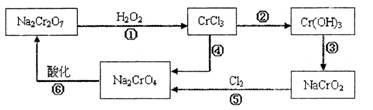
已知: (1) 铬元素有以下循环过程:
(2) Cu(OH)2能溶于氨水:
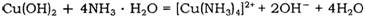
请回答下列问题:
(1) 加入试剂甲的目的:________________
(2) 试剂乙的名称:________ ,试剂丙的化学式:________________
(3) 上述操作I、II、III相同,则进行该实验操作所需要的主要玻璃仪器有________________
(4) 滤渣I的主要成分为________________(写化学式)。
(5) 在铬元素循环过程的反应①中每反应掉1 mol H2O2同时消耗H+数目为:______________
(6) 铬元素循环过程的反应⑥的离子方程式:_____________________________;
废水处理流程中生成滤渣III的离子方程式:_______________________
查看答案和解析>>
科目: 来源:2011年安徽省高一年级化学竞赛试卷 题型:填空题
去冬以来,我国很多地方持续干旱,为此,农业专家建议尽快发展高能抗旱保水剂。保水剂是一种强吸水树脂,能在短时间内吸收自身重量几百倍至上千倍的水分。聚丙烯酸钠就是一种高吸水性树脂。下面是丙烯合成聚丙烯酸钠的化工流程:

请回答下列问题:
(1) 上述反应中属于加成反应的有____________,反应⑧的反应类型为____________;
(2)写出A的结构简式_______________,D中的官能团有____________;
(3) F是D的同系物,式量比D大14,写出2种符合下列要求的F的同分异构体(不考虑顺反异构)__________________ , ______________________;
①链状分子 ②与新制氢氧化铜在加热条件下反应生成红色沉淀
③与NaOH溶液混合后滴入酚酞,加热,溶液颜色变浅
(4)写出下列反应的化学方程式:
③_____________________________________________。
⑧_____________________________________________。
查看答案和解析>>
科目: 来源:2011年安徽省高一年级化学竞赛试卷 题型:实验题
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物, 溶于稀硫酸生成Cu和CuSO4, 在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3 假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂。
⑴若假设1成立,则实验现象是 。
⑵若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗? ,简述你的理由(不需写出反应的方程式 )
⑶若固体粉末完全溶解, 向所得溶液中滴加 KSCN 试剂时溶液不变红色 , 则证明原固体粉末是 ,写出实验过程中发生的氧化还原反应的离子方程式
探究延伸:若经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
⑷实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b > a),则混合物中Cu2O的质量分数为 。
⑸某铝土矿样品经测定是由Al2O3、Fe2O3、 FeO、 SiO2等氧化物组成,取样品适量放入烧杯中,加入稀硫酸将其溶解,过滤,取滤液少量于试管中,若证明滤液中含有+2价的铁,选用的试剂和现象为 .
查看答案和解析>>
科目: 来源:2011年安徽省高一年级化学竞赛试卷 题型:计算题
在隔绝空气的条件下,某同学将一块被氧化钠覆盖的钠块用一张刺有小孔的纯净铝箔包好,然后放入盛满水且倒置于水槽中的容器内。待反应完全后,在容器中收集到1.12 L H2(标准状况,忽略溶解的氢气的量),测得铝箔质量比反应前减少了0.27g,水槽和容器内溶液的总体积为2.0L,溶液中NaOH的浓度为0.050mol·L-1。 试通过计算确定该钠块中钠元素的质量分数(精确到0.1%)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com